绝密★启用前
信阳市十一高2005-2006学年下期期中考试高一化学试题
命题:李志鹏 审核:河南省化学基础教育教研室 2006年4月13日
注意事项:
1.本试卷分第Ⅰ卷(选择题)和第Ⅱ卷(非选择题)两部分。满分100分。考试时间90分钟。
2.可能用到的相对原子质量:H—1 C—12 N—14 O—16 Na—23 S—32 Cl—35.5 I—127
第I卷(选择题,共45分)
一、选择题(本题包括15小题,每小题3分,共45分,每小题有一个选项符合题意)
1.2006年4月22日是第37个“世界地球日”,我国确定的主题是“善待地球-珍惜资源、持续发展”。下列行为中不符合这一主题的是
A.采用“绿色化学”工艺,使原料尽可能转化为所需要的物质
B.大量开采地下水,以满足社会对水的需求
C.减少直至不使用对大气臭氧层起破坏作用的氟氯烃
D.节约能源,提高能源利用率
2.我国的“神舟六号”载人飞船已发射成功,“嫦娥”探月工程也已正式启动。据科学家预测,月球的土壤中吸附着数百万吨的![]() ,每百吨
,每百吨![]() 核聚变所释放出的能量相当于目前人类一年消耗的能量。在地球上,氮元素主要以
核聚变所释放出的能量相当于目前人类一年消耗的能量。在地球上,氮元素主要以![]() 的形式存在。下列说法正确的是
的形式存在。下列说法正确的是
A.![]() 原子核内含有4个质子
原子核内含有4个质子
B.![]() 和
和![]() 互为同位素
互为同位素
C.![]() 原子核内含有3个中子
原子核内含有3个中子
D.![]() 的最外层电子数为2,所以
的最外层电子数为2,所以![]() 具有较强的金属性
具有较强的金属性
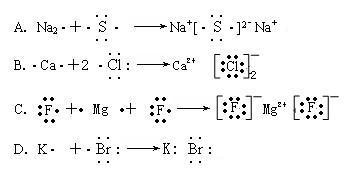 |
3.下列用电子式表示物质形成过程正确的是
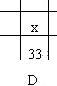
4.下图为元素周期表的一部分(数字为原子序数),其中x不能和氢硫酸发生置换反应生成硫的是
 |  |  |  | ||||
5.镭是第七周期ⅡA族元素,下列关于镭的性质的叙述中,不正确的是
A.镭单质与H2O发生剧烈反应,放出H2
B.镭的碳酸盐难溶于H2O
C.镭的金属性比钙强
D.氢氧化镭是两性氢氧化物
6.下列微粒的半径,随着原子序数的递增而增大的是
A.O2-、F-、Na+ B.Al、Si、P C.Mg2+、Al、S2- D.P、S、Cl
7.x元素的两个原子各失去一个电子,转移到一个可获得两个电子的y原子上生成化合物,下列说法中不正确的是
A.该化合物的化学为X2Y B.此化合物是以离子键形成的离子化合物
C.此化合物中存在X2+阳离子和Y-阴离子 D.y元素位于ⅥA族
8.x、y、z是三种主族元素,若x的阳离子与y的阴离子具有相同的电子层结构,z的阴离子半径大于等电荷的y的阴离子的半径,则三种元素的原子序数大小顺序为
A.z>y>x B.z>x>y C.x>y>z D.x>z>y
9.O2在放电的情况下,共有30﹪转化为O3,当温度和压强相同时,则放电前后气体的密度之比为
A.10:9 B.9:10 C.3:2 D.2:3
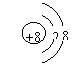 10.下列微粒①Mg2+、②[:
10.下列微粒①Mg2+、②[:![]() :]- ③ 、④Ne、 ⑤
:]- ③ 、④Ne、 ⑤![]() ,核外电子数相等的是
,核外电子数相等的是
A.①②③④ B.①②④⑤ C.①③④⑤ D.②③④⑤
11.下列关于核素的叙述正确的是
A.同种核素的质子数目一定相同
B.质子数相同的原子一定属于同种元素
C.同种元素的不同核素的原子具有不同的化学性质
D.两种原子中子数相同,一定属同种核素
12.有五种微粒分别为![]() 、
、![]() 、
、![]() +、
+、![]() 2+、
2+、![]() 它们属于几种元素
它们属于几种元素
A.2种 B.3种 C.4种 D.5种
13.根据氧族元素的性质推断,硒不可能具有的性质是
A.在通常情况下是固体 B.SeO3对应的水化物是一种酸
C.H2Se比H2S稳定 D.有-2、+4、+6三种化合价
14.下列说法正确的是
A.能使澄清石灰水变浑浊的气体是CO2
B.能使品红溶液褪色的气体一定是SO2
C.同一条件下,相同体积的SO2和Cl2通入H2O中,所得溶液的漂白性增强
D.SO2是污染大气的有害物质之一,但是它有消毒灭菌作用
15.下列离子方程式不正确的是
A.气体通入Ba(OH)2溶液中 SO2+Ba2++2OH-=BaSO3↓+H2O
B.实验室用H2SO4和Na2SO3制SO2 SO32-+2H+=SO2↑+H2O
C.向亚硫酸氢钠溶液中滴入硫酸氢钠溶液 HSO3-+H+=H2O+SO2↑
D.向Al(OH)3悬浊液中滴入烧碱溶液 Al(OH)3+OH-=Al3++2H2O
| 题号 | 一 | 二 | 三 | 四 | 总分 |
| 得分 |
|
|
|
|
|
| 题号 | 1 | 2 | 3 | 4 | 5 | 6 | 7 | 8 | 9 | 10 | 11 | 12 | 13 | 14 | 15 | 得分 |
| 答案 |
第II卷(非选择题,共55分)
二、实验题(包括两小题,共24分)
16.如图所示,当向大试管中缓缓加入浓硫酸时,烧杯中的水溶液变浑浊,试回答:
(1)烧杯中所盛的水溶液是发生反应的化学方程式为_____________________________.
 |
(2)小试管内的碳酸氢铵发生了什么变化,写出有关的化学方程式:_______________________.
(3)解释发生上述反应的原因_________________________________________________________.
(4)碳酸氢铵化肥应如何保存_________________________________________________________.
17.(16分)根据下图回答问题:
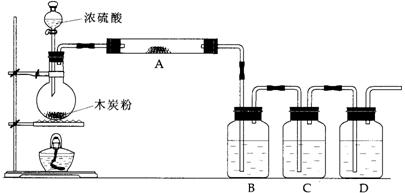
(1)上述装置中,在反应前用手掌紧贴烧瓶外壁检查装置的气密性,如观察不到明显的现象,还可以用什么简单的方法证明该装置不漏气。
答:
(2)写出浓硫酸和木炭粉在加热条件下发生反应的化学方程式:
(3)如果用图中的装置检验上述反应的全部产物,写出下面标号所表示的仪器中应加入的试剂的名称及其作用:
A中加入的试剂是 ,作用是 。
B中加入的试剂是 ,作用是 。
C中加入的试剂是 ,作用是除尽 气体。
D中加入的试剂是 ,作用是 。
(4)实验时,C中应观察到的现象是 。
三、填空题(本题共三小题,共20分)
18.A、B、C三种元素为短周期元素,A元素的阴离子不被任何氧化剂氧化,则A离子的结构示意图为___________;1molB的单质能从盐酸中置换出3gH2,此时B转化为与Ne原子具有相同电子层结构的离子,则B元素是________,B的最高价氧化物对应的水化物的化学式为________,该化合物中的化学键属___________.
19.O3、H2O2、SO2均可用于漂白,其中_________的漂白原理不同于其他二者,从化合价、氧化还原反应角度考虑,O3和SO2的水溶液______(填“能”或“不能”)发生反应,若能反应,SO2被__________(填“氧化”或“还原”)的产物是____________.
20.有X、Y、Z是原子序数相连的三种元素。元素X获得电子成为的离子;元素Z失去电子成为稳定的离子下列说法:
①元素Y的原子中电子数较X原子多一个,但比Z原子少一个;
②元素X的原子与氢反应能形成HX;
③元素Z为活泼的金属,跟水反应放出氢气生成物的水溶液显碱性;
④元素Y和Z、X可以反应
其中正确的是_______________(填序号)
21.(10分)分别处于第三和第四两个周期的主族元素A和B,它们形成的离子相差两个电子层,已知A元素位于周期表中的m主族:B元素位于周期表中的n主族,B单质的分子中含有共价键。试回答:
(1)A原子的核外电子数可用关系式(含m的式子)___________表示,它的离子符号为__________。
(2)B原子的质子数可用关系式(含n的式子)___________表示,它的离子的符号为__________。
(3)若A和B形成化合物的化学式为AB2,用电子式表示AB2形成过程_____________。
四、计算题(本题包括两小题,共11分)
22.某元素A,它的最高价氧化物的化学式是A2O5,气态氢化物中氢的质量分数为8.82﹪,且A原子中质子数比中子数少1,A是________元素,它在元素周期表位于第______周期第______族.
23.臭氧(O3)能与KI溶液反应生成氧气等.向反应后的溶液中滴入酚酞,溶液变为红色,若滴入淀粉,溶液则变为蓝色.为测定环境中空气的臭氧含量,将0℃、1.01×105Pa的空气33.6m3通过KI溶液,使反应完全,在所得溶液中用0.100mol·L-1的Na2SO3溶液60.0mL恰好滴定达终点,反应为:2 Na2SO3+I2=Na2S4O6+2NaI
(1)臭氧通入KI溶液中的化学反应方程式是________________________________.
(2)计算大气中臭氧的体积分数.
信阳市十一高2005-2006学年下期期中考试高一化学试题
参考答案
1-15 CBCDD CCBBA AACDA
16.(1)澄清灰水(答案不唯一)
Ca(OH)2+CO2=CaCO3↓+H2O
(2)NH4HCO3发生分解
NH4HCO3 NH3↑+H2O+CO2↑
(3)因为NH4HCO3不稳定,受热易分解,而浓H2SO4溶于水H2O放热,放出热量足以使NH4HCO3分解,分解的产物之一CO2使澄清石灰水变浑浊。
(4)密闭、防热、防晒
17.(1)答:反应前先用小火加热烧瓶,B、C、D瓶中有气泡冒出,停止加热后,水会升到导管里形成一段水柱,证明装置不漏气。
(2)2H2SO4(浓)+C![]() CO2↑+2SO2↑+2H2O
CO2↑+2SO2↑+2H2O
(3)无水硫酸铜 检验 H2O
品红溶液 检验 SO2
足量酸性 KMnO4 溶液 SO2
澄清石灰水 检验 CO2
(4)导管有气泡冒出;溶液紫色逐渐变浅;瓶底有少量黑色固体生成。
 |
18.F-
![]() Al
Al(OH)3 两 离子键
Al
Al(OH)3 两 离子键
19.SO2 能 氧化 H2SO4
20.①②③
21.⑴10+m Am+
⑵28+n B(8-n)-
⑶
22.A为P元素,第三周期VA族
23.此题为多步反应的计算,重点在于找出已知物质和所求物质之间的关系
由方程式:2KI+O3+H2O=2KOH+O2+I2
2Na2S2O3+I2=Na2S4O6+2NaI
可得关系式:
O3~2Na2S2O3
1mol 2mol
n(O3) 0.0100mol·L-1×0.0600L
所以n(O3)=![]()
=3.00×10-4mol
大气中臭氧的体积分数为:![]() ×100﹪=2.00×10-5﹪
×100﹪=2.00×10-5﹪