安徽华星学校2005—2006学年度第二学期期中考试试卷
高一化学
( 时间:100分钟 满分:100分 命题人:裴张帝 )
本卷可能用到的原子相对质量:H-1 C-12 N-14 O-16 F-19 Na-23 Mg-24 S-32 Cl-35.5 Ba-137
班级: 姓名: 得分:
第I卷(选择题,共50分)
一、选择题(本题包括25小题,每小题2分,共50分。每小题只有一个选项符合题意。答案写在答题卡上)
1、具有放射性元素的原子能自动地放射出一些固定的粒子,使得这些元素的原子经过放射变成了另一种元素的原子,据此推断放射出的粒子一定是 ( )
A.电子 B.中子 C.质子 D.原子核
2、最近,医学家们用放射性的14C标记的C60发现:一种C60的羧酸衍生物在特定条件下,
可以通过断裂的DNA杀死细胞,从而抑制艾滋病(AIDS)。下列有关14C的说法 正确的是 ( )
A.与C60中的普通碳原子的化学性质不同 B.与14N所含中子数相同
C.与C60是同素异形体 D.与12C互称同位素
3、某元素的原子最外层有两个电子, 该元素 ( )
A.是ⅡA族元素 B.是金属元素
C.是稀有气体元素 D.无法确定属哪一类
4、某元素R的原子的质量数为70,其核内中子数为39,它的离子有28个电子,则此元素的氧化物的化学式应为 ( )
A.RO B.R2O3 C.RO2 D.R2O5
5、能证明铝的金属性比镁弱的实验事实是 ( )
A.铝的原子半径比镁小
B.镁与浓硫酸反应,铝与冷的浓硫酸不反应
C.Al(OH)3能溶于NaOH溶液,而Mg(OH)2不能
D.铝的金属光泽不如镁显著
6、下列说法正确的是( )
A.难失去电子的原子,易形成阴离子
B.单质分子中不存在化学键,化合物的分子才存在化学键
C.离子化合物中一定含有离子键
D.共价化合物中可能含有离子键
7、原子(![]() E)的核外电子中,K层和L层电子数之和等于M层电子数的2倍, 则
Z的数值是 ( )
E)的核外电子中,K层和L层电子数之和等于M层电子数的2倍, 则
Z的数值是 ( )
A.12 B.15 C.16 D.17
8、同周期的A、B、C三元素,其最高价氧化物对应水化物的酸性强弱顺序是: HAO4>H2BO4>H3CO4,则下列判断错误的是 ( )
A.原子半径A>B>C
B.气态氢化物稳定性HA>H2B>CH3
C.非金属性A>B>C
D.阴离子还原性C3->B2->A-
9、现有bXn- 和aYm+ 两种离子,它们的电子层结构相同,则a与下列式子有相等关系的是 ( )
A.b-m-n B.b+n+m C.b-m+n D.b+m-n
10、下列表示电子式的形成过程正确的是 ( )
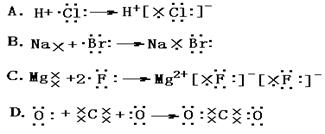
11、下列化合物中既含有离子键又含有极性键的物质是 ( )
A.NaOH B.NH3 C.Na2O2 D.CaCl2
12、元素X的原子获得3个电子和元素Y的原子失去2个电子后,它们的电子层结构与氖原子的电子层结构相同,X、Y两种元素的单质在高温下得到的化合物的化学式正确的为 ( )
A.Y3X2 B.X2Y2 C.X3Y2 D.Y2X3
13、比较下列各组微粒半径,正确的是 ( )
①Cl<Cl-<Br- ②F-<Mg2+<Al3+ ③Na+<Na<K ④S2-<Cl-<Br-
A.①和③ B.只有② C.只有③ D.①和④
14、在周期表主族元素中,甲元素与乙、丙、丁元素上下或左右相邻。甲、乙两元素的原子序数之和等于丙元素的原子序数,这四种原子的最外成电子数之和为20,据此判断四种元素在 周期表的位置是( )
|
|
|
|
15、A和B是短周期的两种元素, 它们的离子A-和B2+具有相同的核外电子层结构,
下列说法正确的是 ( )
A.原子序数A>B B.电子数A>B
C.原子半径A>B D.离子半径A->B2+
16、如果发现了原子序数为116的元素,对它的叙述不正确的是 ( )
A.位于第七周期 B.属于氧族元素
C.一定是金属 D.最高价氧化物对应的水化物可能是强酸
17、现在含有元素硒的保健品已开始进入市场.已知硒与氧同族与钾同周期,则下列
关于硒的叙述中不正确的是 ( )
A.非金属性比溴强 B.最高价氧化物的化学式SeO3
C.原子序数为34 D.气态氢化物的化学式为H2Se
18、硫的非金属性弱于氯的非金属性,其最主要的事实是 ( )
A.硫不溶于水,而氯气溶于水
B.通常状态下硫为淡黄色晶体,而氯气为黄绿色气体
C.在与金属形成的化合物中硫为-2价,而氯为-1价
D.在跟同一金属(如Cu或Fe)反应时,金属被硫氧化成低价态,被氯氧化成高价态
19、取6.4g铜与足量浓硫酸加热反应,另取含0.2mol H2SO4的浓硫酸与足量的
铜反应,分别收集产生的二氧化硫气体,问在相同条件下哪个体积大 ( )
A.前者大 B.后者大 C.一样大 D.无法判断
20、对下列事实的解释正确的是 ( )
A.在蔗糖中加入浓硫酸后出现发黑现象,说明浓硫酸具有吸水性
B.浓硫酸和浓盐酸混合可制氯化氢,说明浓硫酸是一种难挥发性强酸
C.常温下浓硫酸可以用铝罐储存,说明常温下Al与浓硫酸不反应
D.反应CuSO4+H2S=CuS↓+H2SO4 ,说明硫化铜既不溶于水,也不溶于稀硫酸
21、下列关于臭氧的叙述错误的是 ( )
A.臭氧层能够吸收来自太阳的大部分紫外线,对人类健康和动植物都有保护作用,
但由于氟氯烃等物质的破坏,臭氧层的臭氧正在逐渐减少
B.臭氧能杀死空气中的病菌,因此室内尽量多制造出臭氧,净化空气, 有利于人的健康
C.臭氧和氧气都是氧元素构成的单质,因此臭氧和氧气都是氧的同素异形体
D.臭氧具有漂白性和消毒作用的原理与氯气基本相同
22、按核电荷数的增大,氧族元素的下列性质按递增顺序排列的是 ( )
①单质的熔点 ②元素的非金属性 ③氢化物的还原性
④与氢气反应的能力 ⑤ +6价氧化物对应水化物的酸性 ⑥阴离子的半径
A.①②③ B.④⑤⑥ C.③④⑤ D.①③⑥
23、检验某未知液中是否含有SO42-的下列操作最合理的是 ( )
A.加入硝酸酸化了的硝酸钡溶液,有白色沉淀生成
B.加入盐酸酸化了的氯化钡溶液,有白色沉淀生成
C.先加硝酸酸化,无沉淀,再加硝酸钡溶液,有白色沉淀生成
D.先加盐酸酸化,无沉淀,再加氯化钡溶液,有白色沉淀生成
24、下列化合物不能由相应的元素的单质直接化合得来的是 ( )
① CuS ②FeS ③Al2S3 ④Fe2S3 ⑤Cu2S ⑥FeCl2 ⑦H2Te ⑧H2S
A.②⑤⑧ B.①④⑥ C.③④⑦ D.①④⑥⑦
25、原计划实现全球卫星通讯需发射77颗卫星,这与铱(Ir)元素的原子核外电子数恰好相等,因此称为“铱星计划”,已知自然界中铱有两种质量数分别为191和193的同位素,而铱的平均相对原子质量为192.22,则![]() 原子个数比应为 ( )
原子个数比应为 ( )
A . 61∶39 B. 30∶61 C.1∶1 D.39∶11
答题卡
| 1 | 2 | 3 | 4 | 5 | 6 | 7 | 8 | 9 |
|
|
|
|
|
|
|
|
|
|
| 10 | 11 | 12 | 13 | 14 | 15 | 16 | 17 | 18 |
|
|
|
|
|
|
|
|
|
|
| 19 | 20 | 21 | 22 | 23 | 24 | 25 |
|
|
|
|
|
|
|
|
|
|
|
|
第Ⅱ卷(非选择题 50分)
二、填空题(本题包括5小题,共28分)
26、(4分) 用化学符号表示符合下列条件的微粒:
(1)含有10个电子的分子有: Ne、 HF 、H2O 、 和 CH4。
(2)含有10个电子的阳离子有: Na+、Mg2+ 、___ _、NH3+ 和 。
(3)含有10个电子的常见阴离子有:F- 、__ __、和 OH-。
27、(5分) 在O、S、Se、Te 四种元素中,单质氧化性最强的化学式是_ __,简单阴离子还原性最强的离子符号为_ ___,硒元素最高价氧化物的水化物的化学式为__ ___,
它与足量的氢氧化钠溶液反应的化学方程式为 。
28、(7分)在原子序数为 1 — 18 号的元素中, 用适当的化学符号填写下列空白(稀有气体不考虑):
(1) 原子半径最大的是 ______ _。
(2)气态氢化物最稳定的是 _ _ , 气态氢化物中含有H 元素质量分数最大的 氢化物是_ __。
(3)酸性最强的无氧酸是__ __,酸性最强的含氧酸是 _________,碱性最强的是_______,属于两性氢氧化物的物质是___________。
29、(2分)核内中子数为N的R2+ 离子,质量数为A,则m g 它的氧化物中所含质子的物质的量是_______________。
30、(10分)在元素周期表1——18号元素中,A元素的单质能与水剧烈反应放出气体,A成为稳定的气态氢化物;B元素的气态氢化物溶于水,溶液呈碱性;C元素阳离子与A元素的阴离子电子层结构相同,0.1mol C单质与足量盐酸反应,生成的H2在标准状况下体积为3.36L;D元素与C元素在同一周期,且D元素的原子最外层有4个电子。
⑴、A、B、C、D的元素符号分别是 , , , 。
⑵、用电子式表示B的气态氢化物的形成过程: 。
⑶、写出在可溶性C盐溶液中逐滴加入氢氧化钠溶液直至过量的离子方程式: 。
⑷、A单质的氧化性比B单质 ,C单质的还原性比D单质 。(填“强”或“弱”)
三、推断题(6分)
31、A、B是两种有刺激性气味的气体,试根据以下物质之间的反应关系推断:
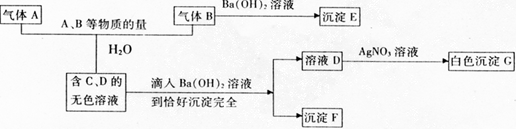
(1)A→G各是什么物质,其化学式分别是:A________,B________,E______,F________,
(2)写出A、B与水三者反应的化学方程式:______________________________________。
四、实验题(10分)
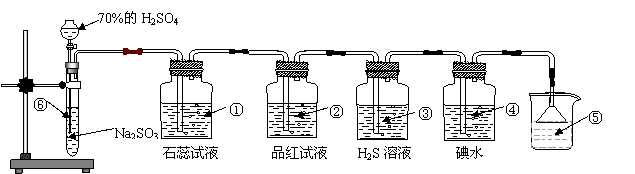
32、下图是实验室制取SO2并验证SO2某些性质的装置图。试回答:
⑴、⑥中发生反应的化学方程式为 。
⑵、①中的实验现象为 。
⑶、②中的品红溶液变红,证明SO2有 。
⑷、③中的实验现象是 ,证明SO2有 性。
⑸、④中的实验现象是 ,反应的化学方为 。
⑹、⑤的作用是 。
 |
五、计算题(共6分)
33、取100mLNa2CO3和Na2SO4的混合液,加入过量BaCl2溶液后得到14.51g白色沉淀,用过量稀硝酸处理后沉淀质量减少到4.66g,并有气体放出。试计算:
(1)原混合物中Na2CO3和Na2SO4的物质的量浓度。
(2)产生的气体在标准状况下的体积。
安徽华星学校2005—2006学年度第二学期期中考试答案
高一化学
一、 选择题(本题包括25小题,每小题2分,共50分。)
| 1 | 2 | 3 | 4 | 5 | 6 | 7 | 8 | 9 |
| C | D | D | B | C | C | B | A | B |
| 10 | 11 | 12 | 13 | 14 | 15 | 16 | 17 | 18 |
| D | A | A | A | D | D | D | A | D |
| 19 | 20 | 21 | 22 | 23 | 24 | 25 |
|
|
| A | D | B | D | D | D | A |
|
|
二、 填空题(本题包括5小题,共28分化学方程式2分,其余为1分)
(4分)26、NH3 、Al3+、 NH4+、 O2-
(5分) 27、O2 、Te2- 、H2SeO4 、H2SeO4 + 2 NaOH ====== Na2SeO4 + H2O
(7分)28、Na、HF、CH4、HCl、HClO4、NaOH、Al(OH)3
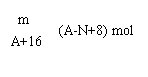 |
![]() (2分)29、
(2分)29、
H
![]()
![]() (10分)30、⑴
F、N、Al、Si
⑵ N +
3 H
H N
(10分)30、⑴
F、N、Al、Si
⑵ N +
3 H
H N
H
⑶ Al3+ + 4OH- ==== AlO2- + H2O ⑷ 强 、强
三、推断题
(6分)31、⑴ Cl2、 SO2 、 BaSO3 、 BaSO4
⑵ Cl2 + SO2 ====== 2 HCl + H2SO4
四、实验题
(10分)32、⑴H2SO4 + Na2SO3 ======= Na2SO4 + SO2↑ + H2O
⑵ 石蕊试液变红 ⑶ 漂白性 ⑷ 溶液变浑浊、氧化性
⑸ 碘水褪色 I2 + SO2 ====== 2 HI + H2SO4
⑹ 吸收SO2防止污染环境。
五、计算题
(共6分)33、解:由题意可知,用稀硝酸处理后,沉淀应为BaSO4, 则其质量为
m(BaSO4)= 4.66g ,所以m(BaCO3)=14.51- 4.66=9.85 g ( 2分 )
| ||||
| ||||
![]()
![]() 所以n(BaSO4) =
=0.02 mol n(B aCO3) =
=0.05 mol
所以n(BaSO4) =
=0.02 mol n(B aCO3) =
=0.05 mol
c(BaSO4) = 0.2 mol.L- c(B aCO3) = 0.5 mol.L-(3分)
n (CO2) = n(B aCO3)= 0.05 mol V(CO2) =1.12 L (1分)
答:略