 2005~2006学年度第二学期期中测试
2005~2006学年度第二学期期中测试
高一化学试卷(理科)
卷面总分:100分 考试时间:100分钟
可能用到的相对原子质量:H-1 O-16
第I卷(共两大题,40分)
一、选择题(每小题2分,每题只有一个选项符合题意,共16分)
1、 随着人们生活质量的不断提高,废电池必须进行集中处理的问题被提议事日程,其首要原因是:
A.利用电池外壳的金属材料
B.防止电池中汞、镉和铅等重金属离子对土壤和水源的污染
C.不使电池中渗泄的电解液腐蚀其他物品
D.回收其中的石墨电极
2、 下列物质属于烃类的是:
A.四氟乙烯 B.碳酸 C.溴苯 D.十六烷
3、![]() 原子的核外电子数:
原子的核外电子数:
A.大于 B.小于 C.等于 D.不能肯定
4、下列电子式书写错误的是:
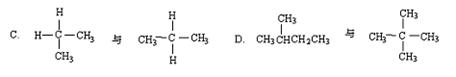
5、下列各对物质中属于同分异构体的是:
A.![]() 和
和![]() B.O2和O3
B.O2和O3
 6、用铁片与稀硫酸反应制取氢气时下列措施不能使氢气生成速率加大的是:
6、用铁片与稀硫酸反应制取氢气时下列措施不能使氢气生成速率加大的是:
A.加热 B.不用稀硫酸,改用98%浓硫酸
C.滴加少量硫酸铜溶液 D.不用铁片,改用铁粉
7、按常温常压下沸点升高的次序,排列正确的是:
①正丁烷 ②壬烷 ③异丁烷 ④三十烷
A.②③①④ B.③①②④ C.①③②④ D.无法确定
8、下列各组指定原子序数的元素,能形成AB2型共价化合物的是:
A.12和17 B.12和9 C.16和8 D.11和16
二、选择题(每小题2分,每题有1—2个选项符合题意,共24分)
9、下列说法正确的是:
A.放热反应一定是断开反应物中的化学键吸收的能量比形成生成物中的化学键放出的能量少
B.1molH2SO4和1molBa(OH)2完全反应所放出的热量称为中和热
C.反应物的总能量低于生成物的总能量的化学反应为放热反应
D.在化学反应中需要加热的反应就是吸热反应
10、下列关于化学反应速率的说法正确的是:
A.化学反应速率是指一定时间内任何一种反应物浓度的减小或任何一种生成物浓度的增加
B.化学反应速率为0.8 mol/(L•s)是指1s时某物质的浓度为0.8mol/L
C.根据化学反应速率的大小可以知道化学反应的相对快慢
D.对于任何化学反应来说,反应速率越大,反应现象越明显
11、有AZX与A+1ZX+两种粒子的叙述正确的是:
A. 一定都由质子、中子和电子组成
B. 化学性质几乎相同
C.质子数一定相同,质量数和中子数一定不同
D.核电荷数和核外电子数一定相同
12、下列微粒中,与NH4+的质子数和电子数都相同的是:
A.HF B.H3O+ C.Na+ D.OH-
13、燃料电池是将燃料(如H2、CH4、CO)跟氧气(或空气)起反应将化学能转变为电能的装置,电解质溶液常是强碱溶液。下列有关甲烷燃料电池的说法不正确的:
A.正极反应为O2+4H++4e-→2H2O
B.负极反应为CH4+8OH- - 8e-→CO2+6H2O
C.随着放电工作,溶液的PH减小
D.甲烷燃料电池的能量利用率比甲烷燃烧的高
14、下列有机物分子中,所有原子在同一平面上的是:
A.甲烷 B.二氯甲烷 C.乙烯 D.苯
15、下列关于化学键的说法正确的是:
A.构成单质分子的微粒中一定含有共价键
B.由非金属元素组成的化合物不一定是共价化合物
C.非极性键只存在于双原子分子中
D.不同元素组成的多原子分子里的化学键一定都是极性键
16、原子序数大于4的主族元素X、Y的离子Xm+ Yn- ,两者核外电子排布相同,关于X、Y的叙述正确的是:
A.X和Y在同一周期 B.原子半径X一定大于Y
C.两元素族序数之差为8-m-n D.X、Y核电荷数之差为8-m-n
17、下列叙述中错误的是:
A.点燃甲烷不必像点燃氢气那样事先验纯
B.甲烷燃烧能放出大量的热,所以是一种很好的气体燃料
C.煤矿的矿井要注意通风和严禁烟火,以防爆炸事故的发生
D.如果隔绝空气,将甲烷加热到1000℃以上,甲烷分解生成炭黑和氢气
18、下列各组物质在一定条件下反应可制得较纯净的1,2-二氯乙烷的是
A.乙烷与氯气混合 B.乙烯与氯化氢气体混合
C.乙烯与氯气混合 D.乙烯通入浓盐酸
19、A+、B2+、C-、D2- 四种离子核外电子排布相同,四种离子半径大小及形成四种离子所对应四种元素的原子序数由大到小排列顺序分别是:
①C->D2->A+>B2+ ② B2+ > A+>C->D2- ③B2+ >A+>D2->C- ④D2->C->A+> B2+
A. ②④ B .①③ C. ④② D. ③①
20、若锌与稀硝酸反应时有下列化学方程式:
4Zn + 10HNO3 == aZn(NO3)2 + bM + cH2O,则a、b、c、M可能是:
| A | B | C | D | |
| a | 4 | 4 | 4 | 4 |
| b | 1 | 1 | 2 | 3 |
| c | 5 | 3 | 4 | 5 |
| M | N2O | NH4NO3 | NO2 | NO |
第II卷(一大题,共60分)
三、填空题(共60分)
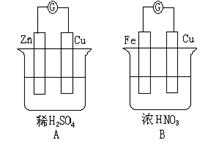
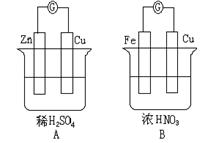 21、(11分)如图,请读题并填空:
21、(11分)如图,请读题并填空:
(1) 在A图中, 上(填Zn或Cu,
下同)冒H2气泡。 的质量不变。
溶液中的H+ 流向 极,SO42-流向 极。
电极反应式:锌板: ;
铜板: 。
(2)在B图中,常温下 极为负极,Fe电极上的电极反应式为: ,总反应方程式为: 。经过一段时间后,停止反应并搅均溶液,溶液的pH值 (升高、降低、不变。)
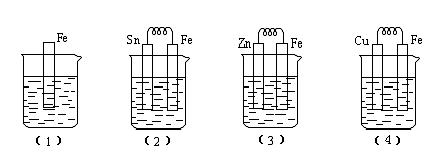
22、(4分)如下图所示,烧杯中都盛有稀硫酸。(1)中反应的离子方程式为 ,比较(1)、(2)、(3)、(4)中纯铁被腐蚀的速率由快到慢的顺序是 。
23、(9分)回答以下问题时,请用化学用语。在短周期中:
(1)原子半径最小的原子是________,氧化性最强的单质是______,最高价氧化物的水化物酸性最强的含氧酸是_____________,氢的质量分数最大的气态氢化物是________。
(2) 第三周期中,最高价氧化物的水化物的碱性最弱的碱是_________;离子半径最小的离子的离子结构示意图为________________,该元素最高价氧化物对应的水化物为 (填物质所属类别),请用离子方程式证明你的观点 。
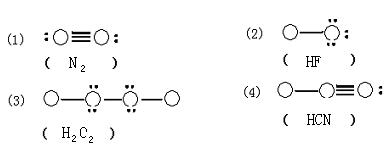
24、(6分)以下列出了四种物质的分子结构示意图。其中圆圈表示原子核以及包含除价电子以外的电子的示意图,黑点表示非共用电子对,直线表示共价键,且图中各分子仅是由一、二周期元素的原子构成的。在括号里填写四种物质的分子式。
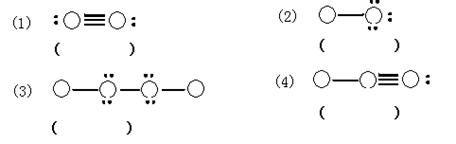
25、(6分)有原子序数都小于20的A、B、C、D、E、F六种元素,A、B、C三种元素的简单离子都具有3个电子层,其半径依次增大,A与B能形成离子化合物,E元素的原子最外层有2个电子,A与D,C与F分别同主族,D、E、F在不同周期。写出该六种元素的元素符号。
A___ __B__ __C___ ___D__ ____E___ ___F____ ___
26、(10分)在横线上完成(1)(2)(3)题的反应方程式,并在括号中注明反应类型,在有机产物的下方注明该物质的名称:
(1) 甲烷与氯气在光照条件下发生的第一步反应
(2) 乙烯使溴水褪色
(3) 苯与浓硝酸在一定条件下的反应
(4)乙烯使酸性高锰酸钾溶液褪色的反应类型为( )
27、(6分)A元素的最高价离子0.5mol被还原成中性原子时,要得到6.02×1023个电子,它的单质与盐酸充分反应时,放出0.02g的H2,用去0.4克A。B元素的原子核外电子层数与A相同,且B元素形成的单质在常温下是红棕色的液体.
(1)写出两种元素的名称:A ,B 。
(2)写出A、B两元素常见离子的结构示意简图A , B 。
(4) 用电子式表示A、B形成化合物的过程。
![]()
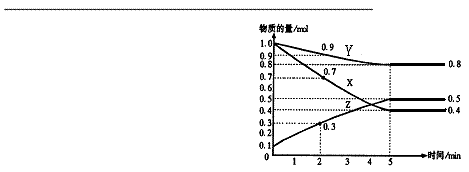
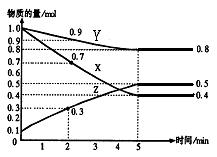 28、(8分)某温度时,在2L容器中X、Y、Z三种物质随时间的变化关系曲线如图所示。
28、(8分)某温度时,在2L容器中X、Y、Z三种物质随时间的变化关系曲线如图所示。
(1) 由图中的数据分析,该反应的化学方
程式为 ;
(2) 反应开始至2min、5min时Z的平
均反应速率分别为 、 ;
(3)若10℃时测得反应速率VX=0.3 mol·L-1·s-1
50℃时反应速率VY =25.6 mol·L-1·s-1,则温度每升高10℃,该反应速率增至原来的 倍
A.3倍 B.4倍 C.16倍 D.85倍
 2005~2006学年度第二学期期中测试
2005~2006学年度第二学期期中测试
高一化学试卷(理科)答题纸
卷面总分:100分 考试时间:100分钟
第I卷答题处:
一、 选择题(每小题2分,每题只有一个选项符合题意,共16分)
| 题号 | 1 | 2 | 3 | 4 | 5 | 6 | 7 | 8 |
| 答案 |
二、选择题(每小题2分,每题有1—2个选项符合题意,共24分)
| 题号 | 9 | 10 | 11 | 12 | 13 | 14 | 15 | 16 | 17 | 18 | 19 | 20 |
| 答案 |
第II卷答题处:
三、填空题(共60分)
 21、(11分)
21、(11分)
(1) 。 。
, 。
电极反应式:锌板: ;
铜板: 。
(2) ,Fe电极上的电极反应式为: ,总反应方程式为: 。
22、(4分) ,
。
23、(9分)
(1)_____ ___, ___ ___, _______ ______, _____ ___。
(2) _____ ____;
________________, ,
离子方程式 。
24、(6分)
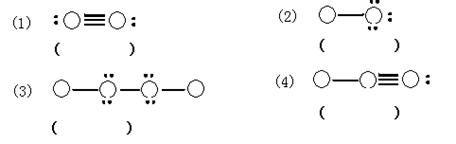
25、(6分)
A___ __B__ __C___ ___D__ ____E___ ___F____ ___
26、(10分)
![]() (1)
(1)
![]() (2)
(2)
![]() (3)
(3)
(4) ( )
27、(6分)(1)A ,B 。
(2)A , B 。
(3)
 |
28、(8分)
(1) ;
(2) 、 ;
(3) 。
 2005~2006学年度第二学期期中测试
2005~2006学年度第二学期期中测试
高一化学试卷(理科)答案
一、 选择题(每小题2分,每题只有一个选项符合题意,共16分)
| 题号 | 1 | 2 | 3 | 4 | 5 | 6 | 7 | 8 |
| 答案 | B | D | C | A | D | B | B | C |
二、选择题(每小题2分,每题有1—2个选项符合题意,共24分)
| 题号 | 9 | 10 | 11 | 12 | 13 | 14 | 15 | 16 | 17 | 18 | 19 | 20 |
| 答案 | A | C | C | BC | AB | CD | B | BC | A | C | C | AB |
第II卷答题处:
三、填空题(共60分)
 21、(11分)
21、(11分)
(1) Cu 。 Cu 。
Cu , Zn 。
电极反应式:锌板: Zn – 2e- = Zn2+;
铜板: 2H+ + 2e- = H2
(2) Cu ,Fe电极上的电极反应式为: NO3‑ + e- + 2H+ =NO2 + H2O ,总反应方程式为: Cu + 4HNO3 = Cu(NO3)2 +NO2↑+2H2O (2分,离子方程式也可以)。升高 (其余每空1分)
22、(4分) Fe + 2H+ = Fe2+ + H2↑ ,
(4)(2)(1)(3) 。(每空两分)
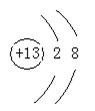 23、(9分)(每空1分)
23、(9分)(每空1分)
(1)_____H___, ___ F2__, ____HClO4__, ___CH4__。
(2)____ Mg(OH)2___; ________ ______,
两性氢氧化物 ,
离子方程式 Al(OH)3 + 3H+ = Al3+ + 3H2O; Al(OH)3+ OH- =AlO2- +2H2O 。
24、(6分)(1、2小题每题1分,3、4小题每题2分)
25、(6分)(每空1分)
A___K__ B__ Cl __ C___S___ D_ H___ E__Mg___ F__O____
26、(10分)(答案略,每空1分)
![]() (1)
(1)
![]() (2)
(2)
![]() (3)
(3)
(4) ( )
27、(6分)(1)A 钙 ,B 溴 。(各1分)
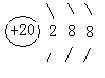 | |||
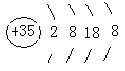 | |||
(2)A ,(1分) B (1分)
(3)
![]() (略,2分)
(略,2分)
 28、(8分)(每空2分)
28、(8分)(每空2分)
(1) 3X + Y ≒ 2Z ;(不用可逆号不给分)
(2) 0.05mol•L-1•min-1 、 0.04mol•L-1•min-1 ;
(3) B 。