淮安中学2005年第一学期高一化学试卷(必修1)【人教版】
高一化学试卷(必修1)
说明:本试卷4页,共120分,考试时间100分钟 (制卷人:解大方)
相对原子质量:H:1 O:16 C:12 N:14 Na:23 S:32 Zn:65
第一部分选择题(70分)
一、选择题(本题包括10小题,每小题3分,共30分。每小题只有一个选项符合题意。)
1. 用特殊的方法把固体物质加工到纳米级的超细粉末粒子,然后制得纳米材料。下列分散系中分散质的微粒直径和这种粒子具有相同数量级的是( )
A 溶液 B 悬浊液 C 胶体 D 乳浊液
2.下列物质的用途错误的是( )
A 硅是制造太阳能电池的常用材料 B 二氧化硅是制造光导纤维的材料
C 水玻璃可用作木材防火剂 D 硅是制取水泥的原料
3. 在下列反应中,水既不是氧化剂又不是还原剂的是 ( )
A F2 + H2O (生成F2和HF) B Na + H2O
C NaH + H2O(生成H2和NaOH) D Na2O2 + H2O
4.下列物质是属于非电解质的是 ( )
A NH3 B (NH4)2SO4 C Cl2 D CH3COOH
5. 碳酸氢钠受热容易分解为碳酸钠。现加热5.00g的碳酸钠和碳酸氢钠的混合物,使碳酸氢钠完全分解,混合物质量减少了0.31g,则原混合物中碳酸钠的质量为 ..( )
A 3.38g B 4.58g C 4.16g D 4.41g
6.下列物质存放方法错误的是( )
A 铝片长期放置在不密封的纸盒里 B 漂白粉长期放置在烧杯中
C FeSO4溶液存放在加有少量铁粉的试剂瓶中 D 金属钠存放于煤油中
7.偏二甲肼(C2H8N2)是一种高能燃料,燃烧产生的巨大能量可作为航天运载火箭的推动力。下列叙述正确的是( )
A 偏二甲肼(C2H8N2)的摩尔质量为60g
B 6.02×1023个偏二甲肼(C2H8N2)分子的质量为60g
C 1 mol 偏二甲肼(C2H8N2)的质量为60 g/mol
D 6g偏二甲肼(C2H8N2)含有NA个偏二甲肼(C2H8N2)分子
8.下列化学方程式中,不能用H++OH-=H2O表示的是( )
A 2NaOH+H2SO4=Na2SO4+2H2O
B Ba(OH)2+2HCl=BaCl2+2H2O
C Cu(OH)2+2HNO3=Cu(NO3)2+2H2O
D KOH+HCl=KCl+H2O
9.下列各组中的离子,能在溶液中大量共存的是( )
A H+ Na+ CO32- Cl- B Ba2+ Na+ Cl- SO42-
C K+ H+ SO42- OH- D Ag+ Al3+ NO3- H+
10.下列情况会对人体健康造成较大危害的是( )
A 自来水中通入少量Cl2进行消毒杀菌
B 用SO2漂白食品
C 用食醋清洗热水瓶胆内壁附着的水垢(CaCO3)
D 用小苏打(NaHCO3)发酵面团制作馒头
二、选择题(本题共10小题。每题4分,共40分。每小题有1~2个正确选择。若两个选项只选一个且正确,只给2分;只要错一个零分)
11.配制一定物质的量浓度的溶液时,不影响实验结果的是( )
A 不需要使用游码称量固体时,被称量的物质和砝码的位置放反了
B 未洗涤烧杯和玻璃棒
C 定容时仰视刻度线
D 容量瓶用蒸馏水洗涤后,未经干燥即用来配制溶液
12.下列选项中,反应后溶液的导电能力比反应前明显增强的是( )
A 向100mL 1mol/L盐酸溶液中加入4g NaOH固体
B 向100mL 1mol/L的醋酸钠溶液中通过量HCl气体
C 向饱和和澄清石灰水中通少量CO2气体
D 通足量的氯气于亚硫酸溶液中
13.将4gNaOH溶液溶解在10ml水里,然后稀释成1L溶液,从中取出10ml,这10ml溶液的物质的量浓度是( )
A 1mol·L-1 B 0.1 mol·L-1 C 0.01 mol·L-1 D 10 mol·L-1
14.现有两瓶溶液,新制饱和氯水和亚硫酸,下列方法或试剂(必要时可加热)能用于鉴别它们的是:①观察颜色;②石蕊试剂;③品红溶液( )
A ①②③ B 只有①③ C 只有②③ D 只有①②
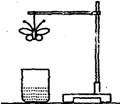 15.某学生用滤纸折成一只纸蝴蝶并在纸蝴蝶上喷洒某种试剂,挂在铁架台上。另取一只盛有某种溶液的烧杯,放在纸蝴蝶的下方(如图)。过一会儿,发现白色纸蝴蝶上的喷洒液转变为红色,喷洒在纸蝴蝶上的试剂与小烧杯中的溶液是.( )
15.某学生用滤纸折成一只纸蝴蝶并在纸蝴蝶上喷洒某种试剂,挂在铁架台上。另取一只盛有某种溶液的烧杯,放在纸蝴蝶的下方(如图)。过一会儿,发现白色纸蝴蝶上的喷洒液转变为红色,喷洒在纸蝴蝶上的试剂与小烧杯中的溶液是.( )
| A | B | C | D | |
| 纸蝴蝶上的喷洒液 | 石蕊 | 酚酞 | 酚酞 | 石蕊 |
| 小烧坏中的溶液 | 浓盐酸 | 浓氨水 | 氢氧化钠溶液 | 浓硫酸 |
16.把3.6g的CO与H2组成的混合气体与足量的O2充分燃烧后,立即通入足量的Na2O2固体中,固体的质量增加为( )
A 2.1g B 3.6g C 7.2g D 无法确定
17.吸入人体內的氧有2%转化为氧化性极强的“活性氧”,它能加速人体衰老,被称为“生命杀手”,服用含硒元素(Se)的化合物亚硒酸钠(Na2SeO3),能消除人体內的活性氧,由此推断Na2SeO3的作用是( )
A 作还原剂 B 作氧化剂
C 既作氧化剂又作还原剂 D 既不作氧化剂又不作还原剂
18.一定量的浓硝酸与过量的铜充分反应,生成的气体是
A 只有NO2 B 只有NO C NO2和NO D NO2和H2
19.在一定条件下,将m体积NO和n体积O2同时通入倒立于水中且盛满水的容器内,充分反应后,容器内残留体积的气体,该气体与空气接触后变为红棕色。则m的n比值为()
A 3:2 B 2:3 C 8:3 D 3:8
20.将铜粉放入稀硫酸中,加热无明显现象发生。但加入某盐后,发现铜粉质量逐渐减少,则该盐可能是( )
A Fe2(SO4)3 B ZnSO4 C KNO3 D NaCl
第二部分非选择题(50分)
一、选择题
| 题号 | 1 | 2 | 3 | 4 | 5 | 6 | 7 | 8 | 9 | 10 |
| 答案 | ||||||||||
| 题号 | 11 | 12 | 13 | 14 | 15 | 16 | 17 | 18 | 19 | 20 |
| 答案 |
二、本题包括4小题,共41分
21.(8分)洪灾过后,饮用水的消毒杀菌成为抑制大规模传染性疾病爆发的有效方法之一。漂白粉是常用的消毒剂。
(1)工业上将氯气通入石灰乳[Ca(OH)2]制取漂白粉,化学反应方程式为
。
(2)漂白粉的有效成分是(填化学式) 。
(3)漂白粉溶于水后,受空气中的CO2作用,即产生有漂白、杀菌作用的次氯酸,化学反应方程式为 。
(4)反应(1)和反应(3)中,属于氧化还原反应的是(填编号) 。
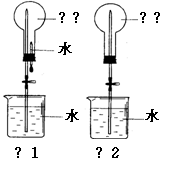 22.(10分) 用右图装置进行喷泉实验(图中夹持装置均已略去)。
22.(10分) 用右图装置进行喷泉实验(图中夹持装置均已略去)。
(1)若用图1装置进行喷泉实验,上部烧瓶已装满干
燥的氨气,引发水上喷的操作是
该实验的原理是
(2)若用图2的装置,请举一例说明引发喷泉的方法。
(3)若用同一烧瓶分别充满如下气体:① HCl ② NH3 ③ NO2进行喷泉实验,实验后烧瓶内溶液液面的高度关系为 (用序号和“>,<或=”表示,下同),所得溶液物质的量浓度大小关系为 。
23.(11分)有两个实验小组的同学用如下图所示的装置进行实验,来探究过氧化钠与二氧化硫的反应
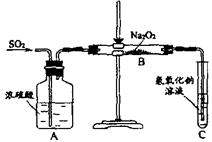
请回答下列问题:
(1)装置C中氢氧化钠溶液的作用是
(2)甲组同学认为Na2O2与SO2反应生成了Na2SO3和O2,该反应的化学方程式是:
请设计一种实验方案证明Na2O2与SO2反应生成的白色固体中含有Na2SO3
(3)乙组同学认为Na2O2与SO2反应除了生成Na2SO3和O2外,还有Na2SO4生成。为检验是否有Na2SO4生成,他们设计了如下方案:


![]()
![]()

上述方案是否合理? 。请简要说明两点理由:
① ;② 。
24.(12分)现有金属单质A、B、C和气体甲、乙、丙及物质D、E、F、G、H,它们之间能发生如下反应(图中有些反应的产物和反应的条件没有全部标出)。
|
|
|
![]()
![]()
![]()
![]()
![]()
![]() ②
②
|
水 金属B 金属C
![]() ①
③
④
①
③
④
|
|
|
![]()
![]()
![]()
![]() ⑥
⑤
⑥
⑤
![]()
![]()
|
请根据以上信息回答下列问题:
(1)写出下列物质的化学式:A 、 B 、 C 、
F 、 H 、 乙
(2)写出下列反应化学方程式:
反应①
反应⑤
反应⑥
三、本题包括1小题,共9分
25.(9分)使一定质量的锌与100mL18.5mol/L浓硫酸充分反应。
(1)若锌完全溶解,只生成SO2气体,其体积在标准状况下为3. 36L,求:所得溶液中硫酸锌的物质的量浓度(假设反应前后溶液体积保持不变)。
(2)若锌完全溶解,同时生成标准状况下混合气体为33.6L,并将反应后的溶液稀释至1L,测得溶液中c(H+)为0.100mol/L,求混合气体中各组分的体积比。
淮安中学2005年第一学期高一化学试卷(必修1)【人教版】
参 考 答 案
第一部分选择题(70分)
| 题号 | 1 | 2 | 3 | 4 | 5 | 6 | 7 | 8 | 9 | 10 |
| 答案 | C | D | D | A | C | B | B | C | D | B |
| 题号 | 11 | 12 | 13 | 14 | 15 | 16 | 17 | 18 | 19 | 20 |
| 答案 | AD | BD | B | A | AB | B | A | C | C | AC |
第二部分非选择题(50分)
二、本题包括4小题,共41分
21.(1)2Cl2 + 2 Ca(OH)2 == Ca(ClO)2 + CaCl2 + 2H2O (2分)
(2)Ca(ClO)2 (2分)
(3)Ca(ClO)2 + CO2 + H2O == CaCO3↓+ 2 HClO (2分)
(4) (1) (2分)
22(1)打开止水夹,挤出胶头滴管中的水。 (2分)
氨气极易溶解于水,致使烧瓶内气体压强迅速减小。 (2分)
(2)打开夹子,用手(或热毛巾等)将烧瓶捂热 (2分)
(3)①=②>③ ①=②=③ (4分)
23.(11分)(1)吸收二氧化硫气体 (2分)
(2).2Na2O2 + 2SO2 =4Na2SO3 + O2↑。取白色固体,加入稀硫酸,产生能使品红溶液褪色的气体。 (4分)
(3)不合理。 ①稀硝酸能使亚硫酸钡转化为硫酸钡。②若反应后残留过氧化钠,它溶于水后能将SO32-转化为SO42-。 (5分)
24.(1)A:Na B:Al C:Fe F:FeCl2 H:Fe(OH)3 乙:Cl2 (各1分,共6分)
(2)反应①:2Na + 2H2O == 2NaOH + H2↑ (2分)
反应⑤:2FeCl2 + Cl2 == 2FeCl3 (2分)
反应⑥:FeCl3+ 3NaOH == Fe(OH)3↓+ 3NaCl (2分)
三、本题包括1小题,共9分
25.(1)Zn + 2H2SO4(浓)![]() ZnSO4 + SO2↑ + H2O
ZnSO4 + SO2↑ + H2O
1mol 22.4L
n(ZnSO4) 3.36L
则X n(ZnSO4)=0.150mol, c(ZnSO4)=1.50mol·L-1
(2)据题意:反应后c(H2SO4)为0.0500mol·L-1,n(H2SO4)为0.0500mol
Zn+2H2SO4(浓)![]() ZnSO4+SO2↑+H2O
ZnSO4+SO2↑+H2O
2n(SO2) n(SO2)
Zn+H2SO4(稀)=ZnSO4+H2↑
n(H2) n(H2)
![]() 2n(SO2)+n(H2)+0.0500mol=0.100L×18.5mol·L-1
2n(SO2)+n(H2)+0.0500mol=0.100L×18.5mol·L-1
n(SO2)+n(H2)=
解得: n(SO2)=0.300mol(6分) n(H2)=1.20mol
则:V(SO2)∶V(H2)=0.300mol∶1.20mol=1∶4