江苏省六合高级中学05-06学年度第二学期高一化学5月考试卷
一、选择题(本题包括10小题,每小题2分,共20分,每小题只有一个正确答案)
1.用于制造隐形飞机的某物质具有吸收微波的功能,其主要成分的结构式如下:
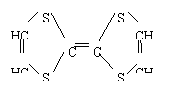 |
它属于( )
A、烃 B、无机物 C、有机物 D、 烷烃
2. 保护环境是每一个公民的责任。下列做法:①推广使用无磷洗涤剂,②城市生活垃圾分类处理,③推广使用一次性木质筷子,④推广使用清洁能源,⑤过量使用化肥、农药,⑥推广使用无氟冰箱。其中有利于保护环境的是
A.①②④⑤ B.①②③④⑥
C.①②④⑥ D.①③④⑥
3.下列反应中,属于加成反应的是( )
A、乙烯使酸性KMnO4溶液褪色
B、将苯滴入溴水中,振荡后水层接近无色
C、乙烯使溴水褪色
D、甲烷与氯气混合,光照一段时间后黄绿色变浅
4.电影《闪闪的红星》中,为让被困的红军战士吃上食盐,潘冬子将浸透食盐水的棉袄裹在身上,带进山中……假如潘冬子在实验室中,欲从食盐水中提取出食盐,最好采用的方法是
A.过滤 B.萃取 C.蒸发 D.蒸馏
5.下面是一些常见分子的比例模型。其1个分子中只含有2对共用电子对的是

A. B. C. D.
6.将下列物质注入水中,振荡后静置,能分层且浮于水面的是
A.溴苯 B.苯 C.乙醇 D.硝基苯
7.当可逆反应在一定条件下达到平衡时,正反应速率v正和逆反应速率v逆的关系是
A.v正>v逆 B.v正<v逆 C.v正=v逆 =0 D.v正=v逆≠0
![]() 8.在C(固)+CO2(气) 2CO(气)的反应中,可使反应速率加快的措施是
8.在C(固)+CO2(气) 2CO(气)的反应中,可使反应速率加快的措施是
①增大压强;②升高温度;③将碳粉碎;④通入CO2;⑤加入碳
A.①②⑤ B.①②③④ C.①②③ D.①②④⑤
9.下列说法正确的是
A.化学反应中的能量变化都表现为热量的变化
B.需要加热才能发生的反应一定是吸热反应
C.放热反应在常温下一定很容易发生
D.反应是吸热还是放热必须看旧键断裂时吸收的能量和新键形成时释放的能量的大小
10.下列共价化合物分子中,所有原子不可能处于同一平面上的是
A.BF3 B.SO3 C.CH3-CH=CH2 D.CH2=CHCl
二. 选择题(本题包括15小题,共30分。每小题有一个或两个选项符合题意,若正确答案只包括一个选项,多选时,该题为0分;若正确答案包括两个选项,只选一个且正确的给1分,选两个且都正确的给2分,但只要选错一个,该小题就为0分。)
11. 下列物质性质的比较,正确的是
A. 熔点:K>Na B. 稳定性:H2S>AsH3
C. 酸性:H3PO4>H4SiO4 D. 还原性:H2O>H2S
12.一定温度下,某一密闭恒容的容器内可逆反应A(g)+3B(g)![]() 2C(g)达到平衡状态的标志是
2C(g)达到平衡状态的标志是
A.C的生成速率与C的分解速率相等
B.容器内混合气体的密度不随时间而变化
C.单位时间内生成n molA,同时生成3n molB
D.A、B、C的分子数之比为1:3:2
13.一种晶体由硼的两种同位素![]() 和
和![]() 构成,5.4g该晶体全部转化为B2H6气体,标况下气体体积为5.6L,则该晶体中
构成,5.4g该晶体全部转化为B2H6气体,标况下气体体积为5.6L,则该晶体中![]() 和
和![]() 两种同位素原子个数比为
两种同位素原子个数比为
A.1∶1 B.1∶3 C.1∶2 D.1∶4
14.有一类组成最简单的有机硅化合物叫硅烷,它的分子组成和结构与烷烃相似。下列说法错误的是
A.硅烷的分子通式可表示为SinH2n+2
B.甲硅烷(SiH4)燃烧生成二氧化硅和水,
C.甲硅烷的密度小于甲烷
D.甲硅烷的热稳定性强于甲烷
15.白铁皮(镀锌铁)发生(析氢)腐蚀时,如有0.4mol电子发生转移,下列说法中正确的是
A.有11.2g金属被氧化 B.有13g金属被氧化
C.产生的气体在标准状况下为4.48L D.产生的气体在标准状况下为8.96L
|
|
的密闭聚乙烯管安装在房屋的外墙内就能达到白天蓄热使室内保持低温度;晚上把白天所蓄热量放出,使室内保持温暖。以下说法正确的是
A.白天将太阳能转化为化学能 B.白天将化学能转化为太阳能
C.晚上将化学能转化为热能 D.晚上将热能转化为化学能
17.等质量的铜分别与足量浓硫酸、稀硝酸充分反应,下列说法正确的是
A.被还原的酸的物质的量相等 B.被氧化的铜的物质的量相等
C.提供H+ 的酸的物质的量相等 D.转移电子的物质的量相等
18.水蒸气中常含有部分(H2O)2,要确定(H2O)2的存在,可采用的方法是
A.1kg水蒸气冷凝后与足量金属钠反应,测定产生氢气的体积
B.1L水蒸气通过浓硫酸后,测定浓硫酸增重的质量
C.该水蒸气冷凝后,测定水的pH
D.该水蒸气冷凝后,测定氢氧原子比
19. 在常温下,把一个盛有一定量甲烷和氯气的密闭玻璃容器放在光亮的地方,两种气体发生反应,下列叙述中不正确的是
A.容器内原子总数不变 B.容器内分子总数不变
C.容器内压强不变 D.发生的反应属于取代反应
20.铊(Tl)是某超导材料的组成元素之一,与铝同族,位于第6周期。Tl3+与Ag在酸性介质中发生反应:Tl3++ 2Ag == Tl+ + 2Ag+。下列推断正确的是
A.Tl+的最外层有1个电子 B.Tl3+的氧化性比Al3+弱
C.Tl能形成+3价和+1的化合物 D.Tl+的还原性比Ag强
21.两种气态烃组成的混合气体0.1mol ,完全燃烧得0.16mol CO2和3.6g H2O ,下列说法正确的是
A、混合气体中一定有甲烷
B、混合气体中一定没有甲烷
C、混合气体一定是甲烷和乙烯
D、混合气体中一定有丁烷
22.某有机物在氧气中充分燃烧,生成的水蒸气和二氧化碳的物质的量之比为1∶1,由此可以得出的结论是
A、该有机物分子中的C、H、O的个数比为1∶2∶3
B、分子C、H原子个数比为2∶1
C、有机物中必定含氧
D、无法判断有机物中是否含有氧元素
23.下列有机物分子中,所有的原子一定在同一平面内的是
![]()
![]() A、
B、
A、
B、
C、 D、
24.下列各组化合物中,不论二者以什么比例混合,只要总质量一定,则完全燃烧时消耗O2的质量和生成水的质量不变的是
A、CH4、C2H6 B、C2H6、C3H6
C、C2H4、C3H6 D、C2H4、C3H4
 25.下列化合物分别跟液溴在铁粉催化作用下反应,苯环上的氢原子被取代所得的一溴取代物有3种同分异构体的是
25.下列化合物分别跟液溴在铁粉催化作用下反应,苯环上的氢原子被取代所得的一溴取代物有3种同分异构体的是
 |
B、
 | |||
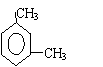 | |||
C、 D、
三、填空题(本题共7小题,共50分)
26.(4分)下面是关于汽车燃料及其燃烧产物性质的问题:下图对三种不同类型的汽车(以序号(1)、(2)、(3)表示)的废气排放情况进行比较。这三种汽车分别是以汽油为燃料的汽车、以天然气(主要成分是甲烷)为燃料的汽车和电动汽车。请判断其中序号为1的是
汽车,序号为3的是 汽车。
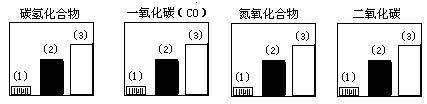
27.(6分)按要求填写化学用语:
(1) 甲基的电子式 ; (2)第四周期 ⅦA族元素的元素符号 ;
(4)次氯酸的结构式 ; (5)乙烯的结构简式 。
(6)羟基的电子式 ; (7)氢氧根离子的电子式 。
28.(6分) 元素在周期表中的位置,反映了元素的原子结构和元素的性质。右图是元素周期表的一部分。
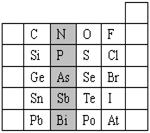 (1)阴影部分元素N在元素周期表中的位置为第 。
(1)阴影部分元素N在元素周期表中的位置为第 。
根据元素周期律,请你预测:H3AsO4、H3PO4 的酸性强
弱 。
(2)元素S的最高正价和最低负价分别为 ,在一定
条件下,S与H2反应有一定限度(可理解为反应进行的程度),
请判断在相同条件下Se与H2反应的限度(选填“更大”、
“更小”或“相同”) 。
(3)Br2具有较强的氧化性,SO2具有较强的还原性,将SO2气体通入溴水后,溶液中存在的主要离子是 。
29.(4分)(1)某烷烃中的碳、氢质量比为5:1,已知该烷烃的一氯代物只有一种,该烃分子的结构简式为 ,名称为 。
(2)0.15mol某气态烷烃完全燃烧需消耗0.75mol氧气,则该烃的分子式为 。
30.(5分)写出下列变化的化学方程式,并注明反应条件和反应类型。
(1)乙烯和氯化氢 。
(2)苯和浓硝酸 。
(3)苯和液溴 。
(4)苯和氢气 。
(5)丙烯(CH2=CH—CH3)和溴水 。
31.(6分)下图中各物质均由短周期元素组成,其中只有D、F、G为单质,A为淡黄色固体,B为常见的无色液体,一定条件下D、G和海水为原料可制成海洋电池。
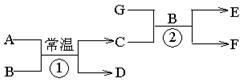
按要求填空:
(1)写出电子式A _____________ B______________
(2)写出化学方程式①_________________________________________________________
②_________________________________________________________
(3)写出D、G和海水制成海洋电池的负极反应式_______________________________。
32.(6分)海水占地球总储水量的97.2%。若把海水淡化和化工生产结合起来,既可以解决淡水资源缺乏的问题,又可以充分利用海洋资源。
(1)海水中含有大量的氯化钠。氯化钠中的非金属元素位于元素周期表第 族。
(2)目前国际上实用的“海水淡化”主要技术之一是蒸馏法。蒸馏法是将海水变成蒸汽,蒸汽经过冷却而得高纯度淡水,由此可判断蒸馏法是 (填物理变化、化学变化)
(3)工业上利用电解饱和食盐水可制得重要化工产品,反应式为:
2NaCl+2H2O![]() 2NaOH+H2↑+Cl2↑。利用该反应中电解所得气体制36.5%的浓盐酸1000t,最少需要消耗食盐 t。
2NaOH+H2↑+Cl2↑。利用该反应中电解所得气体制36.5%的浓盐酸1000t,最少需要消耗食盐 t。
(4)近年来有人提出了一种利用氯碱工业产品及氯化钠循环治理含二氧化硫废气并回收二氧化硫的方法,该方法的流程如下:
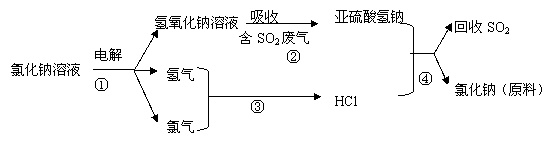
写出②④的化学反应方程式:
五、计算题:(本题共13分)
33.(5分) 利用碳棒锌片和200ml稀硫酸组成原电池,将化学能转化为电能,当碳棒上共产生3.36L(标准状况)气体时,硫酸恰好全部被消耗。试计算:
(1)有多少个电子通过了导线。
(2)原稀硫酸溶液的物质的量浓度。
34.(4分)某气态烷烃和乙烯等体积混合时,1体积该混合气体完全燃烧消耗4.75体积氧气,
试求:(1)烷烃的化学式。
(2)混合气体中乙烯的质量分数。
35.(4分)某烷烃和烯烃(通式是CnH2n)混合气2.24L(标准状况),点火使其完全燃烧,将燃烧产物通过浓硫酸后,浓硫酸质量增加4.05g; 再通过碱石灰,碱石灰质量增加6.60g;另取等量混合气,通入过量溴水中,溴水质量增加1.05g。
(1)通过计算和分析判断混合气由哪两种烃组成?
(2)计算两种烃的物质的量之比。
参考答案
选择题:
| 1 | 2 | 3 | 4 | 5 | 6 | 7 | 8 | 9 | 10 | |||||
| C | C | C | C | C | B | D | B | D | C | |||||
| 11 | 12 | 13 | 14 | 15 | 16 | 17 | 18 | 19 | 20 | 21 | 22 | 23 | 24 | 25 |
| BC | A | D | CD | BC | AC | BD | B | C | C | A | D | A | C | AC |
非选择题:
26.电动汽车;以汽油为燃料的汽车
27.略
28.(1)第二周期第VA族;H3PO4>H3AsO4(2)+6、-2 ; 更小(3)H+、Br―、SO42―
29.(1)(CH3)4C;新戊烷(2) C3H8
30.略
31.(1)略
(2)①2Na2O2+2H2O === 4NaOH + O2 ↑
② 2Al + 2NaOH + 2H2O === 2NaAlO2 + 3H2 ↑
(3)Al―3e―==Al3+
32.(1)ⅦA (2)物理变化 (3)585 t
(4)SO2 + NaOH ==NaHSO3 ;NaHSO3 + HCl ==NaCl + SO2↑+ H2O
33、(1)约1.806×1023个(0.3NA个) (2) 0.75mol/L
34、(1) C4H10 (2)32.56%
35、(1) CH4、C3H6 ;(2) n(CH4)∶n(C3H6) =3∶1