单 元 检 测
一、选择题(每小题只有一个选项符合题意)
1.据报导,上海某医院正在研究用放射性同位素碘![]() 治疗肿瘤。该同位素原子核内的中子数与核外电子数之差是
治疗肿瘤。该同位素原子核内的中子数与核外电子数之差是
A.72 B.19 C.53 D.125
2.电子总数相等的微粒叫等电子体。下列各组微粒中不属于等电子体的是
A.CH4与NH3
B.Ca2+与Cl- C.CO2与HCl
D.OH-与NH![]()
3.居里夫人发现的镭是主族元素,它的最外层为第七层,且只有2e-,下列有关它的描述中错误的是
A.在化合物中只呈现+2价
B.氢氧化物呈两性
C.原子半径在本族元素中最大
D.单质与水反应能放出氢气
二、选择题(每小题有一个或两个选项符合题意)
4.短周期元素M和N的离子M2+和N2-具有相同电子层结构,说法正确的是
A.M2+的离子半径比N2-小 B.M的原子序数比N小
C.M和N原子的电子层数相等 D.M和N原子最外层电子数相等
5.已知铍的原子序数为4,下列对铍及其化合物的叙述正确的是
A.铍的原子半径大于硼的原子半径
B.氯化铍分子中铍原子的最外层的电子数是8
C.氢氧化铍的碱性比氢氧化钙的弱
D.单质铍跟水反应产生H2
6.关于ⅠA族和ⅡA族元素的下列说法正确的是
A.在同一周期中,ⅠA族单质的熔点比ⅡA族的高
B.浓度都是0.01 mol·L-1时,氢氧化钾溶液的pH比氢氧化钡的小
C.氧化钠的熔点比氧化镁的高
D.加热时,碳酸钠比碳酸镁易分解
7.金刚石和石墨两种晶体里,每个最小碳环里包含的碳原子数
A.前者大 B.后者大
C.相等 D.不能确定
8.已知元素A的某种同位素的硝酸盐A(NO3)m是离子晶体,晶体中A微粒的核内中子数为n,核外电子数为p,则该同位素可表示为
A.![]() A
B.
A
B.![]() A
C.
A
C.![]() A
D.
A
D.![]() A
A
9.下列叙述中正确的是
A.若两种微粒的核外电子排布相同,则化学性质一定相同
B.凡单原子形成的离子,一定具有稀有气体元素原子的核外电子排布
C.如果两原子的核外电子排布相同,则一定属于同种元素
D.不存在质子数和电子数均相同的阴阳离子
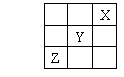 10.短周期元素X、Y、Z在周期表中的位置关系如图所示,其中正确的是
10.短周期元素X、Y、Z在周期表中的位置关系如图所示,其中正确的是
A.Z一定是活泼金属元素
B.X的最高价氧化物的水化物是一种强酸
C.1 mol Y的单质跟足量水反应时,发生转移的电子为2 mol
D.由Z单质形成的晶体属于分子晶体
11.据国外有关资料报道,在独居石(一种共生矿,化学成分为Ge、La、Na……的磷酸盐)中,查明有尚未命名的116、124、126号元素。判断其中116号元素应位于周期表中的
A.第6周期ⅣA族 B.第7周期ⅥA族
C.第6周期ⅧA族 D.第8周期ⅥA族
12.运用元素周期表的变化规律,下列判断不正确的是
A.铍是一种轻金属,它的氧化物对应的水化物可能是两性氢氧化物
B.砹是一种有色固体,它的气态氢化物很不稳定,砹化银是有色沉淀而且不溶于稀硝酸,但易分解
C.硫酸锶难溶于水和稀硝酸,其氢氧化物一定是强碱
D.硒化氢是无色无味气体,没有硫化氢稳定
三、选择题(每题只有一个选项符合题意)
13.金刚石和晶体硅的结构相同,在比较这两个晶体中的相邻原子间距离时,必须取用的下列数值是
①碳和硅的相对原子质量 ②阿伏加德罗常数③硫和硅的原子序数④碳和硅的晶体密度 ⑤碳和硅的质量
A.①② B.②④ C.①②④ D.②③④⑤
14.a——h表示原子序数依次递增的连续的八种元素,其单质的近似熔点如图所示,下列关于这些元素的说法正确的是
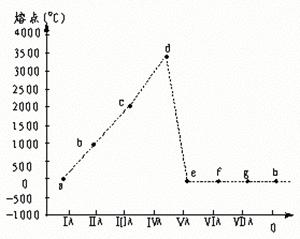
A.必定在第一或第三周期 B.必定在第二周期
C.可能在第四周期 D.可能不在同一周期
15.1987年2月,朱经武(PaulChu)教授等发现钇钡铜氧化合物在90K温度下即具有超导性。若该化合物的结构如右图所示,则该化合物的化学式可能是
A.YBa2CuO7-x B.YBa2Cu2O7-x
C.YBa2Cu3O7-x D.YBa2Cu4O7-x
16.R为短周期元素,其原子所具有的电子层数为最外层电子数的![]() ,它可能形成的含氧酸根离子有:①R2O
,它可能形成的含氧酸根离子有:①R2O![]() ②RO
②RO![]() ③R2O
③R2O![]() ④RO
④RO![]() 下列判断正确的是
下列判断正确的是
A.当它形成①时,可能形成②③
B.当它形成②时,可能形成③④
C.当它形成①时,不可能形成④
D.当它形成②时,可以形成①
三、填空题
17.根据周期律对角线规律,金属Be与铝单质及其化合物的性质相似,又已知AlCl3溶沸点较低易升华,试回答下列问题。
(1)写出Be与NaOH溶液反应的离子方程式(生成Na2BeO2):_____________。
(2)Be(OH)2和Mg(OH)2可用试剂_____________鉴别,其离子方程式如:___________。
(3)BeCl2是______________(填离子化合物或共价化合物),其电子式为_________,BeCl2水溶液呈酸性,其水解的离子方程式为:__________________。
18.X、Y、Z三种常见的短周期元素,可以形成XY2、Z2Y、XY3、Z2Y2、Z2X等化合物,已知Y的离子和Z的离子有相同的电子层结构,X离子比Y离子多1个电子层。试回答:
(1)X离子的结构简图为_______________________________;
(2)工业上由XY2制取XY3的化学方程式为______________________;
(3)Z2Y对应水化物的碱性比LiOH__________________;
(4)Z2Y2的电子式为______________,其中含有__________键和_________键。Z2Y2溶在水中的反应方程式为__________________。
(5)Z2X属于______________晶体,它与氯水反应的离子方程式为_____________。
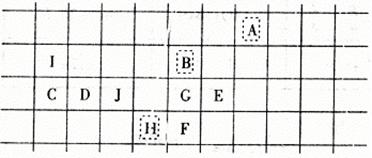
19.(99·上海)设想你去某外星球做了一个科学考察,采集了该星球上十种元素单质的样品,为了确定这些元素的相对位置以便系统地进行研究,你设计了一些实验并得到下列结果:
| 单质 | A | B | C | D | E | F | G | H | I | J |
| 熔点℃ | -150 | 550 | 160 | 210 | -50 | 370 | 450 | 300 | 260 | 250 |
| 与水反应 | √ | √ | √ | √ | ||||||
| 与酸反应 | √ | √ | √ | √ | √ | |||||
| 与氧气反应 | √ | √ | √ | √ | √ | √ | √ | √ | ||
| 不发生化学反应 | √ | √ | √ | |||||||
| 相对A元素的原子质量 | 1.0 | 8.0 | 15.6 | 17.1 | 23.8 | 31.8 | 20.0 | 29.6 | 3.9 | 18.0 |
按照元素性质的周期递变规律,试确定以下十种元素的相对位置,并填入下表:
| A | |||||||||
| B | |||||||||
| H | |||||||||
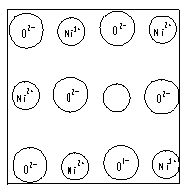 20.(1)中学教材上图示了NaCl晶体结构,它向三维空间延伸得到完美晶体。NiO(氧化镍)晶体的结构与NaCl相同,Ni2+与最邻近O2-的核间距离为a× 10-8cm,计算NiO晶体的密度(已知NiO的摩尔质量为74.7g·mol-1)。
20.(1)中学教材上图示了NaCl晶体结构,它向三维空间延伸得到完美晶体。NiO(氧化镍)晶体的结构与NaCl相同,Ni2+与最邻近O2-的核间距离为a× 10-8cm,计算NiO晶体的密度(已知NiO的摩尔质量为74.7g·mol-1)。
(2)天然的和绝大部分人工制备的晶体都存在各种缺陷,例如在某种NiO晶体中就存在如右图所示的缺陷:一个Ni2+空缺,另有两个Ni2+被两个Ni3+所取代。其结果晶体仍呈电中性,但化合物中Ni和O的比值却发生了变化。某氧化镍样品组成为Ni0.97 O,计算该晶体中Ni3+与Ni2+的离子数之比。
附本节参考答案:
1.B 2.C 3.B 4.A 5.AC 6.B 7.C 8.D 9.CD 10.BD 11.B 12.D 13.C 14.B 15.C 16.B
17.(1)Be+2OH-====BeO22-+H2↑
(2)NaOH溶液 Be(OH)2+2OH-====BeO22-+2H2O
![]() (3)共价化合物
(3)共价化合物 ![]() ,Be2++2H2O Be(OH)2+2H+
,Be2++2H2O Be(OH)2+2H+
|
(5)离子,Cl2+S2-====2Cl-+S↓
19.
20.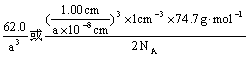
(2)6∶91