江苏南京一中05-06学年度第二学期高一第一次阶段性测试
可能用到的相对原子质量:H-1;C-12;N-14;O-16;Li-7;Be-9;Na-23;Mg-24;Al-27;P-31;S-32;Cl-35.5;K-39;Ca-40;Fe-56;Mn-55;Br-80;Rb-85; I-127。
第Ⅰ卷(共46分)
一、选择题(只有一个选项符合题意,2×8=16分)
1. 原子核内的质子数决定
A. 原子的种类 B. 质量数的多少
C. 元素的种类 D. 物质的性质
2.下列电子式书写错误的是
![]()
3. 下列叙述正确的是
A. 40K和40Ca的原子中质子数和中子数都不相等
B. 金刚石和石墨的性质相同
C. H2和D2互为同位素
D. 12C和13C互为同素异形体
4. 某元素R的最高价氧化物的水化物的化学式为H2RO3,该元素的气态氢化物中氢元素的质量分数为25%,此元素在周期表中的位置为
A. 第2周期ⅣA族 B. 第2周期ⅥA族
C. 第3周期ⅣA族 D. 第3周期ⅥA族
5. 2003年,IUPAC(国际纯粹与应用化学联合会)推荐原子序数为110的元素的符号为Ds,以纪念该元素的发现地(Darmstadt,德国)。下列关于Ds的说法不正确的是
A.Ds原子的电子层数为7 B.Ds是超铀元素
C.Ds原子的质量数为110 D.Ds为金属元素
6. 下列关于物质性质的比较正确的是
①同主族元素的单质从上到下,熔点增高
②元素的最高正化合价在数值上等于它所在的族序数
③同周期主族元素的原子半径越小,越难失去电子
④元素的非金属性越强,它的气态氢化物水溶液的酸性越强
⑤还原性:S2->Se2->Br->Cl-
⑥酸性:HClO4>H2SO4>H3PO4>H2SiO3
A. ①③ B. ②④ C. ③⑥ D. ⑤⑥
7.已知X、Y、Z、T四种非金属元素,X、Y在反应时各结合一个电子形成稳定结构所放出的能量是Y>X;氢化物的稳定性是HX>HT;原子序数T>Z,其稳定结构的离子核外电子数相等,而其离子半径是Z>T。四种元素的非金属性从强到弱排列顺序正确的是
A. X、Y、Z、T B. Y、X、Z、T
C. X、Y、T、Z D. Y、X、T、Z
8. 由含有1H 、2H两种核素的氢气与溴在一定条件下反应生成HBr。经试验测知,反应中产生了四种相对分子质量不同的HBr分子,由此可推知溴元素所具有的核素的数目有
A. 1 B. 2 C. 3 D. 4
二、选择题:(有1~2个选项符合题意,3×10=30分)
9. 下列含有共价键的离子化合物有
A. HCl B. Na2O2 C. NH4F D. MgBr2
10. 下列物质变化可形成离子键的是
A. 白磷在空气中燃烧 B. 镁在空气中失去光泽
C. 硫磺在氧气中燃烧 D. 氯化氢气体溶于水
11. 酸根RO3-所含电子数比硝酸根NO3-的电子多10,则下列说法正确的是
A. R原子的电子层数比NO3-中的N的电子层数多1
B. RO3-中R的化合价与NO3-中的N的化合价相等
C. 元素N的非金属性强于R
D. R和N为同族元素
12.X、Y都是短周期元素,X原子的最外电子层上有4个电子,Y原子的最外电子层上有6个电子,则X与Y形成化合物的化学式可能为
A.XY2 B.X2Y2 C.YX2 D.XY
13. 氯的原子序数为17,35Cl是氯的一种核素,下列说法正确的是
A. 35Cl所含质子数为18
B. 1/18mol的1H35Cl分子所含中子数约为6.02×1023个
C. 70g 35Cl2气体的体积为22.4L
D. 35Cl2的相对分子质量为70g/mol
14. 下列说法错误的是
A. 共价化合物中,一定含有共价键,可能含有离子键
B. 离子化合物中,一定含有离子键,可能含有共价键
C. 气体单质分子中,不一定存在共价键
D. 存在共价键的分子不一定是化合物分子
15. A、B两种元素原子的质子数之和为21,A原子核外电子数比B原子核外电子数少5个,下列有关叙述不正确的是
A. A是非金属性较强的元素 B. B的氧化物是碱性氧化物
C. A、B能形成离子化合物 D. A、B能形成含30个电子的阴离子
16. X、Y是短周期元素,若两者形成化合物X2Y,则X、Y的原子序数之差不可能是
A.1 B.2 C.3 D.4
17. 主族元素X、Y、Z的离子分别为aX+、bY2-、cZ-,其离子半径大小关系是:X+<Z-<Y2-。下列说法错误的是
A. 单质的还原性X>Z B. Y 2-的还原性大于Z -
C. X、Y可处于同周期或X在Y的下一周期 D. b一定小于c
18. 阿伏加德罗常数的符号为NA,下列叙述正确的是
A.常温常压下,32g氧气和臭氧的混合物中约含2NA个氧原子
B.1mol氖气所含原子数为2NA
C.标准状况下,11.2L四氯化碳中含共价键数为2 NA
D.在铜与硫的反应中,1mol铜失去的电子数为2 NA
第Ⅱ卷(共54分)
三、填空题
19.(6分)用化学方程式(是离子反应的请写出离子方程式)解释下列结论
(1) Al(OH)3是两性氢氧化物
(2) Cl-的还原性弱于I-
(3) K的燃烧比Na剧烈
(4) 碳酸的酸性强于硅酸
20.(9分)在短周期与碱金属、卤素、氧族元素中(不考虑放射性元素),用化学符号填写:
(1)原子半径最小的原子是 ,金属性最强的元素是 ,地壳中含量最多的金属元素是 。
(2)与水反应最剧烈的非金属单质是 ,最轻的金属单质是 ,具有半导体性质的单质是 。
(3)酸性最强的最高价氧化物的水化物是 ,不能直接化合生成气态氢化物的非金属是 ,短周期中碱性最强的氢氧化物是 。
21.(4分)A2+、B+、C、D-四种粒子的电子总数均为10个,A2+为简单离子,B+、D-中都含有共价键,B+和D-反应可以生成X2Y型共价化合物C,请回答:
(1)A2+的电子式 ,B+的电子式 ;
(2)B+和D-反应的离子方程式 ;
(3)用电子式表示C的形成过程 ;
22.(5分)已知A、B、C、D的原子序数都不大于20,其中D比A的原子序数大1,C和D形成CD3型化合物。B是同周期除稀有气体外原子半径最大的原子。D离子和B离子具有相同的电子层结构。A的气态氢化物对氢气的相对密度为17,A的最高价氧化物的式量为80。1.8g C与足量稀硫酸反应,在标准状况下,放出2.24L氢气。A原子核内质子数等于中子数,C原子核内质子数比中子数少1。请回答:
(1)写出元素符号A B C D ;
(2)用电子式表示A、B形成化合物的形成过程:
23. (10分)A、B、C、D均为中学所学的常见物质且均含有同一种元素,它们之间的转化关系如下图所示(反应条件及其他物质已经略去): ![]() 。
。
(1)若A的水溶液能使湿润的红色石蕊试纸变蓝,D的稀溶液能使蓝色的湿润石蕊试纸变红。则A为 ,写出A→B转化的化学方程式:
(2)若A为短周期元素形成的单质,则A有多种情况,请填写下表,并完成相应的化学反应方程式。(有多少填多少,不够可以补充)
| 编 号 | A | B→C化学方程式 |
| 1 | ||
| 2 | ||
| 3 | ||
| 4 | ||
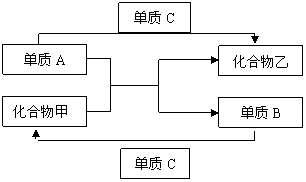 24. (8分)A、B、C是三种元素单质,甲、乙是中学化学中常见的化合物。这些单质和化合物之间存在图示关系。
24. (8分)A、B、C是三种元素单质,甲、乙是中学化学中常见的化合物。这些单质和化合物之间存在图示关系。
(1)若A、B在不同族,请填空
a. 当A是 ,则化合物甲为 。
b. 当A是 ,则化合物甲为 。
(2)若A、B在短周期且同一主族,请填空
a. 当A是 ,则化合物甲为 。
b. 当A是 ,则化合物甲为 。
四、计算题
25.(4分) 某主族元素X的阳离子与Cl-可形成离子化合物A,将A溶于水配成物质的量浓度为0.8mol/L的溶液10mL,该溶液恰好与40mL0.4mol/LAgNO3溶液完全反应,若此10mL A溶液中含A 0.76g,且X阳离子中质子数与中子数相等,求X的相对原子质量,元素名称及在周期表中的位置。
26.(8分)向NaBr与NaI的混合溶液中通入适量Cl2,反应完全后将溶液蒸干并小心灼烧至恒重,得固体W。
(1)W的可能组成为①;_________②_________;③_________;④_________。(填化学式,有多少填多少,不够可以补充)
(2)现将NaBr与NaI的混合固体10.0 g溶于适量水中,通入448 mL Cl2(标准状况)充分反应后,按上述操作得到W的质量为7.28 g。求原混合物中NaI的质量分数。
参考答案
一、
1.C 2.A 3.A 4.A 5.C 6.C 7.D 8.B
(2分×8=16分)
二、
9.BC 10.B 11.AB 12.AD 13.B 14.A 15.B 16.D 17.D 18.A
(3分×10=30分,少选得2分)
三、
19.
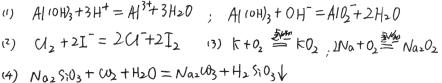
20.(1)H,Cs,Al
(2)F2,Li,Se
(3)HClO4,Te,NaOH
21.
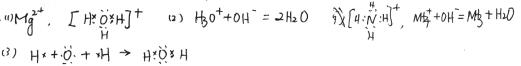
22.(1)A:S B:K C:Al D:Cl
(2)![]()
23.(1)A:NH3,4NH3+5O2![]() 4NO+6H2O
4NO+6H2O
(2)S,2SO2+O2![]() 2SO3
2SO3
C,2CO+O2![]() 2CO2
2CO2
Na,2Na2O+O2==2Na2O2
N2,2NO+O2==2NO2
24.(1)a,F2,H2O b,Fe,H2O
(2)a,O2,H2S b,C,SiO2
四、
25.24,镁,第二周期IIA族
26.(1)①NaBr,NaI,NaCl ②NaBr,NaCl ③NaCl
(2)30.0%