
2005-2006学年度下学期
高中学生学科素质训练
高一化学同步测试(3)—化学键
说明:本试卷分第Ⅰ卷(选择题)和第Ⅱ卷(非选择题)两部分,满分100分,考试用时90分钟.
第Ⅰ卷(选择题,共48分)
一、选择题(本题包括6小题,每小题3分,共18分。每小题只有一个选项符合题意)
1.下列物质中属于离子化合物的是 ( )
A.苛性钠 B.碘化氢 C.硫酸 D.醋酸
2.下列有关化学键的描述正确的是 ( )
A.一种万有引力
B.相邻的两个或多个原子之间的强烈的相互作用
C.一种静电引力
D.相邻的两个原子间的相互作用力
3.能形成离子键的是 ( )
A.任何金属元素与非金属元素间的化合
B.只限于VIIA族元素与IA族元素之间的化合
C.任意两种元素间的化合
D.活泼金属元素与活泼非金属元素间的化合
4.下列关于电子式的说法正确的是 ( )
A.电子式中的小黑点表示原子核外电子
B.简单阳离子的电子式与它的离子符号相同
C.阴离子的电子式与它的离子符号相同
D.电子式就是表示核外电子排布的式子
5.下列化合物中阴离子半径和阳离子半径之比最大的是 ( )
A.LiI B.NaBr C.KCl D.CsF
6.下列表示电子式的形成过程正确的是 ( )
A.![]() B.
B.![]()
C.![]() D.
D.![]()
二、选择题(本题包括10小题,每小题3分,共30分。每小题有一至二个选项符合题意,少选扣1分,多选、错选均不给分)
7.下列化合物中,含有共价键的离子化合物是 ( )
A.NaOH B.MgBr2 C.NH4Cl D.HCl
8.下列性质中,可以证明某化合物内一定存在离子键的是 ( )
A.可溶于水 B.有较高的熔点 C.水溶液能导电 D.熔融状态能导电
9.下列反应过程中,同时有离子键,极性共价键和非极性共价键的断裂和形成的反应是( )
A.NH4Cl![]() NH3↑+ HCl↑ B.2Na2O2+2 CO2
NH3↑+ HCl↑ B.2Na2O2+2 CO2![]() 2Na2 CO3+O2
2Na2 CO3+O2
C.2NaOH+Cl2![]() NaCl+NaClO+H2O D.NH3+CO2+H2O
NaCl+NaClO+H2O D.NH3+CO2+H2O![]() NH4HCO3
NH4HCO3
10.近期《美国化学会志》报道,中国科学家以二氧化碳为碳源,金属钠为还原剂,在470℃、80Mpa下合成出金刚石,具有深远意义。下列说法不正确的是 ( )
A.由二氧化碳合成金刚石是化学变化 B.金刚石是碳的一种同位素
C.钠被氧化最终生成碳酸钠 D.金刚石中只含有非极性共价键
11.对于X—O—H型化合物而言,X是除H、O外的其他元素时,下列说法中正确的是( )
A.当X是活泼金属时,它一定是强碱
B.当X是非金属性很强的元素时,X—O—H一定是强酸
C.X—O—H的水溶液不能导电
D.X—O—H一定是共价化合物
12.下列叙述中正确的是 ( )
A.离子化合物中可能含有共价键
B.共价化合物中可能含有离子键
C.金属离子都一定满足最外电子层2或8电子结构
D.共价化合物中各原子都一定满足最外层8电子结构
13.碱金属与卤素所形成的化合物大都具有的性质是 ( )
①高沸点 ②能溶于水 ③水溶液能导电 ③低熔点 ④熔融状态不导电
A.①④⑤ B.③④⑤ C.①②③ D.②③⑤
14.同主族元素的性质相似,往往可以形成结构和性质相似的化合物,试根据你学过的知识判断。下列有关PH4I(碘化磷)的结构和性质推测结果不正确的是 ( )
A.PH4I可由PH3和HI化合而得
B.PH4I在物质分类中属于正盐
C.PH4I对热不稳定,受热时产生有色气体。
D.PH4I属于共价化合物
15.离子键的强弱主要决定于离子半径和离子电荷数,一般规律是:离子半径小,离子所带电荷值大,则离子键越强。①K2O ②MgO ③CaO三种物质离子键由强到弱的顺序是
( )
A.K2O、MgO、CaO B.MgO、CaO、K2O
C.MgO、K2O、CaO D.CaO、K2O、MgO
16.甲、乙、丙、丁四位学生对发现H3分子的认识,正确的是 ( )
A.甲认为发现H3分子是不可能的,因为违背了共价键理论
B.乙认为宇宙中还存在另一种氢单质,理由是氢有三种同位素,必然有三种同素异形
体
C.丙认为上述发现的存在,证明传统的价键理论有一定的局限性,理论有待于进一步发展
D.丁认为H3分子实质上是H2分子与H+以配位键形式结合的产物,应该写成H3+
第Ⅱ卷(共52分)
三、填空题(共7小题,计52分)
17.(5分)在NaCl、NaOH、Na2O2、O2、H2S、H2O2、NH4Cl、HCl,只含有离子键的是 ,只含有极性键的是 ,含有非极性键的是 ,既含有离子键又含有极性键的是 ,既含有离子键又含有非极性键的是 。
18.(4分)由核电荷数不同的A和B组成的五组元素如下表:
| 组别 | (1) | (2) | (3) | (4) | (5) |
| A的核电荷数 | 2 | 19 | 6 | 9 | 11 |
| B的核电荷数 | 12 | 11 | 16 | 19 | 13 |
其中可以形成离子化合物的一组是________,可以形成共价化合物的一组是_______,元素化学性质十分相似的一组是_______,均属于非金属元素的一组是________。
![]()
![]()
 19.(8分)以下结构中, 代表原子序数从1到10的原子的原子实(原子实是原子除最外层电子后剩余的部分),小黑点代表未用于形成共价键的最外层电子,短线代表共价键(示例:F2: )。
19.(8分)以下结构中, 代表原子序数从1到10的原子的原子实(原子实是原子除最外层电子后剩余的部分),小黑点代表未用于形成共价键的最外层电子,短线代表共价键(示例:F2: )。
![]()
A B C D
根据各图表示的结构的特点,写出该分子的化学式:
A_______________B______________C____________ D_________________
20.(9分)W、X、Y、Z为短周期内除稀有气体外的4种元素,它们的原子序数依次增大,其中只有Y为金属元素。Y和W的最外层电子数相等。Y、Z两元素原子的质子数之和为W、X两元素质子数之和的3倍。由此可知:
(1)写出元素符号:W为_________,X为________,Y为_________,Z为__________。
(2)W2Z是由___________键组成的分子,其电子式为______________。
(3)由Y、X、W组成的物质中有_______键和_______键组成的_______化合物。
21.(7分)A、B、C三种元素为短周期元素。A元素的阴离子不能被任何氧化剂氧化,则A离子的结构示意图为___________,它是_____离子。1 mol B单质能从盐酸中置换出3 g 氢气,此时B转变为与Ne原子具有相同电子层结构的离子,则B元素是_______;B的最高价氧化物的对应水化物的化学式为____________。C元素有3个电子层,且最外电子层比L电子层少2个电子,则C元素是__________;C与Na反应后生成物的电子式为________,化合物中的化学键属于____________。
22.(8分)通常人们把拆开1 mol某化学键所吸收的能量看成该化学键的键能。键能的大小可以衡量化学键的强弱,也可用于估算化学反应的反应热(△H),化学反应的△H等于反应中断裂旧化学键的键能之和与反应中形成新化学键的键能之和的差。
| 化学键 | Si—O | Si—Cl | H—H | H—Cl | Si—Si | Si—C |
| 键能/kJ·mol-1 | 460 | 360 | 436 | 431 | 176 | 347 |
请回答下列问题:
(1)比较下列两组物质的熔点高低(填“>”或“<”)SiC Si; SiCl4 SiO2
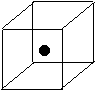 (2)右图立方体中心的“●”表示硅晶体中的一个原子,
(2)右图立方体中心的“●”表示硅晶体中的一个原子,
请在立方体的顶点用“●”表示出与之紧邻的硅原子。
23.(11分)有两种气态单质Am和Bn,已知2.4gAm和2.1gBn所含的原子个数相同,分子个数比是2:3,又知A和B的原子核内质子数都等于中子数,A原子内的L电子层所含电子数是K层电子数的3倍,则:
(1)A和B的元素符号分别是A_________ B__________
(2)Am中的m值是________,Am的同素异形体是__________。
(3)B的气态氢化物与B的最高价氧化物的对应水化物反应生成的化合物的化学式为
_ _______________。
(4)写出B元素与氢元素形成的10电子阳离子及Bn单质的电子式__________、_________。
参考答案
一、选择题
1.A 2.B 3.D 4.B 5.A 6.D
二、选择题
7.AC 8.D 9.B 10.B 11.AB 12.A 13.C 14.D 15.B 16.C
三、填空题
17.NaCl, H2S、HCl, O2 、H2O2、 Na2O2,NaOH、NH4Cl, Na2O2。
18.(4),(3),(2),(3)
19.A:NH3 B:HCN C:CO(NH2)2 D:BF3
20.(1)H,O,Na,S;(2)共价,![]() ;(3)共价,离子,离子
;(3)共价,离子,离子
21.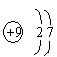 ,氟,
,氟,![]() ,
,![]() ,
,![]() ,
,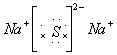 ,离子键
,离子键
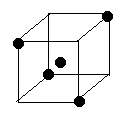
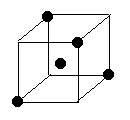 22.(1)> < (2)如图
22.(1)> < (2)如图
23.(1)O、N (2)3 O2 (3)NH4NO3
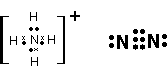
(4)