盐城市明达中学2005/2006学年度第二学期阶段性测试
高一化学试题 2006.3
命题人:颜旺仁
试卷说明:本试卷分I、II卷(满分100分),I卷为选择题,II卷为非选择题,请将答案写在答题纸相应位置上。
第I卷
一、选择题:(本题共有15小题,每小题3分,共45分,每小题只有一个选项符合题意。)
1.19世纪中叶,门捷列夫的突出贡献是 ( )
A.提出原子学说 B.发现元素周期律
C.提出分子学说 D.发现氧气
2.若aAm+与bBn-两种离子的核外电子层结构相同,则有关系 ( )
A.a-m=b+n B.a+b=m-n C.a-b=m-n D.a+m=b-n
3.![]() H、
H、![]() H、
H、![]() H、H+、H2
( )
H、H+、H2
( )
A.氢元素的五种核素 B .五种氢元素
C.氢元素的五种同素异形体 D .氢元素的五种不同微粒
4.下列原子(离子)结构示意图中,不正确的是 ( )
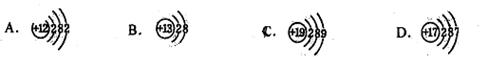 5.在第n电子层中,当它为最外层时,容纳的电子数最多与(n﹣1)层
5.在第n电子层中,当它为最外层时,容纳的电子数最多与(n﹣1)层
相同;当它作为次外层时,其电子数比(n+1)层至多能多容纳10
个电子。则n层为 ( )
A.L层 B.M层 C.N层 D.P层
6.某元素二价阳离子核外有18个电子,质量数为42,该元素原子的原子核中的中子数为 ( )
A. 18 B. 20 C. 22 D. 16
7.下列说法正确的是 ( )
① 非金属元素不可能组成离子化合物
② 构成分子的微粒一定含有共价键
③ 共价化合物中可能含有离子键
④ 离子化合物中可能含有共价键
⑤ 非极性键只存在于双原子单质分子里
⑥ 不同元素组成的多原子分子里的化学键一定都是极性键
A. ①②④⑥ B. ②④⑤⑥ C. ①③⑤⑥ D. 只有④
![]()
![]() 8.下列物质的电子式书写正确的是
( )
8.下列物质的电子式书写正确的是
( )
A. Na2O Na2+[ ]2- B. H2S H+[ ]2-H+
![]()
![]() C. H2O2 D. N2
C. H2O2 D. N2
9.下图各为元素周期表的一部分(数字为原子序数),其中X为35的是
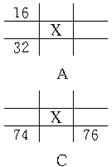
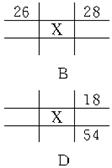
10.两种元素原子的核外电子层数之比与它们的最外层电子数之比相等,在周期表的前10号元素中,满足上述关系的元素共有 ( )
A.1对 B.2对 C.3对 D.4对
11.下列各组微粒具有相同质子数和电子数的是 ( )
A.CH4、NH3、H2O、HF B.OH-、F-、O2-、Ne
C.H3O+、NH4+、Na+、HF D.O2-、F-、Mg2+、Al3+
12.原子结构示意图为: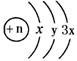 的原子,核电荷数为 ( )
的原子,核电荷数为 ( )
A.2 B.8 C.16 D.18
13.下列各组物质中,全部以共价键结合的是 ( )
A.H2S、NH3、CO2 B.MgBr2、CaO、HCl
C.Na2S、MgO、HF D.CO2、H2O、Na2O2
14.X元素的阳离子和Y元素的阴离子具有与氩原子相同的电子层结构,下列说法不正确的是 ( )
A.X原子序数比Y的大 B.X原子的最外层电子数比Y的小
C.X原子半径比Y的大 D.X元素的最高正价比Y的高
15.能说明Cl的非金属性比S的非金属性强的事实是 ( )
A.Cl2与H2反应生成HCl,而S与H2反应生成H2S
B.向H2S的水溶液中通入Cl2可得到淡黄色的固体S
C.Cl2能与水反应,而S不与水反应
D.Cl原子最外电子层上有7个电子,而S原子最外电子层上有6个电子
二、选择题:(本题包括5小题,每小题4分,共20分,每小题有一个或两个选项符合题意。)
16.镭是元素周期表中第七周期的ⅡA族元素。下面关于镭的性质的描述中不正确的是 ( )
A. 在化合物中呈+2价 B.单质与水反应、放出氢气
C. 氢氧化物呈两性 D.碳酸盐难溶于水
17若某ⅡA族元素的原子序数为x,那么原子序数为(x+1)的元素位于周期表中的 ( )
A.ⅢA族 B.ⅢB族 C.ⅠB族 D.ⅠA族
18有两种短周期元素X和Y,可组成化合物XY3,当Y的原子序数为m时,X的原子序数可能为:①m-4、②m+4、③m+8、④m-2、⑤m+6,共中正确的组合是 ( )
A.①②③④⑤ B.①③⑤
C.②④ D.①②④
19.在一定条件下,短周期元素X和Y能形成化合物XY2,那么X和Y所在族的序数可能是 ( )
A.ⅢA和ⅥA B.ⅡA和ⅦA
C.ⅠA和ⅥA D.ⅣA和ⅥA
20.同周期的X、Y、Z三种元素,已知最高价氧化物的水化物酸性由强到弱的顺序是HXO4>H2YO4>H3ZO4,则下列判断正确的是 ( )
A.非金属性X>Y>Z B.原子半径 X>Y>Z
C.氢化物稳定性HX>H2Y>H3Z D.阴离子的还原性X–>Y2–>Z3–
第II卷
三、填空题
21.(4分)同主族元素从上到下,原子半径依次 ,核对最外层电子的引力依次 ,元素的金属性依次 ,非金属性依次 。
22. (6分)下列12种不同的粒子:2H、35Cl、1H、28Si、37Cl、29Si、3H、17O、18O、1H35Cl、2H35Cl、3H37Cl,其中:
(1).有 种不同的元素;
(2).有 种不同的原子;
(3).互为同位素的原子有
23.(4分)下列五种物质中①Ar ②CO2 ③SiO2 ④NaOH ⑤K2S,存在共价键的是 ,只存在离子键的是 ,既存在离子键又存在共价键的是 ;不存在化学键的是 .(填序号)
|
|
(1).写出A、B、C、D元素的名称:A、____B、____C、____D、___。
(2).D元素在周期表中属于第______周期第______族。
(3).用电子式表示A的气态氢化物的形成过程
。
(4).A和B的单质充分反应生成化合物的电子式是 。
(5).四种元素中,______的最高价氧化物的水化物既能溶于酸,又能溶于碱,溶于NaOH溶液的化学方程式: 。
25.(7分)A、B、C、D四种元素的原子序数均小于18,其最高正价依次为1、4、5、7,已知B的原子核外次外层电子数为2。C、A原子核外次外层电子数均为8。D元素的最高价氧化物对应水化物在同周期中酸性最强。则:
(1). A、B、C、D的元素符号分别是:A ,B ,C ,D 。
(2).A的离子结构示意图为 。
(3).C的最高价氧化物对应的水化物与A的氢氧化物反应可生成 种盐。
(4).C、D的氢化物稳定性由强到弱的顺序是 。
盐城市明达中学2005/2006学年度第二学期阶段性测试
高一化学答题纸 2006.3
| 题号 | 1 | 2 | 3 | 4 | 5 | 6 | 7 | 8 | 9 | 10 |
| 答案 | ||||||||||
| 题号 | 11 | 12 | 13 | 14 | 15 |
| ||||
| 答案 |
| |||||||||
| 题号 | 16 | 17 | 18 | 19 | 20 |
| ||||
| 答案 |
| |||||||||
21. , , ,
22.(1). 种;
(2). 种;
(3).
23. , , , 。(填序号)
24.(1). A、 _B、 C、 _ D、 。(填名称)
(2).第 周期第 族。
(3).
(4).电子式______
(5). 。
25.(1). A ,B ,C ,D 。(填元素符号)
(2).结构示意图为 。
(3). 种。
(4). 。
盐城市明达中学2005/2006学年度第二学期阶段性测试
高一化学参考答案 2006.3
| 题号 | 1 | 2 | 3 | 4 | 5 | 6 | 7 | 8 | 9 | 10 |
| 答案 | B | A | D | C | B | C | D | C | D | B |
| 题号 | 11 | 12 | 13 | 14 | 15 |
| ||||
| 答案 | A | C | A | D | B |
| ||||
| 题号 | 16 | 17 | 18 | 19 | 20 |
| ||||
| 答案 | C | AB | A | BD | AC |
| ||||
21. 增大 , 减弱 , 增强 , 减弱
22.(1). 4 种;
(2). 9 种;
(3).1H、2H、3H;17O、18O;28Si、、29Si;35Cl、37Cl。
23. ②③ , ⑤ , ④ , ① 。(填序号)
24.(1). A、_碳___B、__氧___C、_镁____D、_铝___。(填名称)
(2). 第_三_周期第_ⅢA_族。
(3). 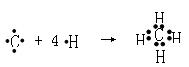
(4). 电子式 ![]()
(5). __D__ Al(OH)3 +NaOH==NaAlO2+2H2O 。
25.(1). A Na ,B C ,C P ,D Cl 。(填元素符号)
(2). 结构示意图为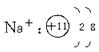
(3). 3 种。
(4). HCl 〉PH3 。