卤素综合能力测试题
一、选择题
1.下列关于氯水的叙述正确的是( )
A.新制氯水中只含Cl2和H2O分子
B.新制氯水可使蓝色石蕊试纸先变红后褪色
C.光照氯水有气泡逸出该气体是Cl2
D.氯水放置数天后PH变小
2.当不慎有大量Cl2逸到周围空气里时,可用浸有一定浓度的下列物质溶液的毛巾捂住鼻子,该物质是( )
A.NaOH B.NaCl C.KBr D.Na2CO3
3.某学生在实验室制取Cl2时可能进行如下操作:①连接好装置检查气密性 ②缓慢加热 ③加入MnO2粉末 ④由分液漏斗向烧瓶里加浓盐酸 ⑤多余的Cl2用NaOH吸收 ⑥用向上排空气法收集Cl2,其正确操作顺序是( )
A.①②③④⑤⑥ B.③④②①⑥⑤
C.①④③②⑥⑤ D. ③①④②⑥⑤
4.下列说法不符合递变规律的是( )
A.F2、Cl2、Br2、I2和H2反应激烈程度递减
B.HF、HCl、HBr、HI热稳定性减小
C.F2、Cl2、Br2、I2的氧化性递增
D.F-、Cl-、![]() 、I-失电子能力递增
、I-失电子能力递增
5.下列物质遇淀粉溶液可以变蓝的是( )
A.氯水 B.碘水
C.碘化钾溶液 D.溴水和碘化钾的混合液
6.Cl和Cl-的共同点是( )
A.有相同的核电荷数 B.都有毒
C.都有氧化性 D.最外层电子数相同
7.MnO2和浓盐酸共热,有73g氯化氢被氧化时,生成Cl2的质量是( )
A.35.5g B.71g C.106.5g D.17.75g
8.下列反应中:①2NaA+B2=2NaB+A2;②2NaA+C2=2NaC+A2;③2NaB+C2=2NaC+B2
④2NaC+D2=2NaD+C2,则A2、B2、C2、D2的非金属性由强到弱的顺序是( )
A.A2、B2、C2、D2 B.B2、A2、C2、D2
C.C2、B2、A2、D2 D.D2、C2、B2、A2
9.欲鉴别Cl-、Br-、I-可以选用的试剂是( )
A.碘水、淀粉溶液 B.氯水、四氯化碳
C.溴水、汽油 D.AgNO3溶液,稀硝酸
10.下列离子方程式正确的是( )
A.氢氧化钡与硫酸反应:H++OH-=H2O
B.小苏打溶液与烧碱溶液反应:HCO3-+OH-=CO32-+H2O
C.氯气通入冷水中:Cl2+H2O=2H++Cl-+ClO-
D.碳酸银溶于稀硝酸:CO32-+2H+=H2O+CO2↑
11.海带中含碘元素.从海带中提取碘有如下步骤:①通入足量Cl2;②将海带熔烧成灰后加水搅拌;③加CCl4振荡;④过滤,合理的操作顺序是( )
A.①②③④ B.②①③④ C.①③②④ D.②④①③
12.有一在空气中暴露过的KOH固体,含H2O2.8%(质量分数,下同),含K2CO37.2%.取1g该样品投入到25mL2mol/L盐酸中,中和多余的盐酸又用去1.07mol/L的KOH溶液30.8mL,蒸发中和后的溶液,所得的固体质量为( )
A.3.73g B.4.00g C.4.50g D.7.45g
13.在空气中能稳定存在的是( )
A.氯水 B.漂白粉 C.生石灰 D.食盐
14.向盛有碘化钾溶液的试管中,加入少量氯水和四氯化碳后,充分振荡,可观察到( )
A.上层为紫色,下层为无色 B.上层液体无色,下层液体紫色
C.上层液体无色,下层液体棕黄色 D.上层液体黄绿色,下层液体紫色
15.碘缺乏病是目前已知的导致人类智力障碍的主要原因.为解决这一全国性的问题,我国已经开始实施“智力工程”,最经济的可行措施是( )
A.食盐加碘(盐) B.面包加碘(盐) C.大量食用海带 D.注射含碘药剂
16.20℃时,NaCl的溶解度是36g,此时NaCl饱和溶液的密度为1.12g/cm3,在此温度下NaCl饱和溶液中NaCl的物质的量浓度为( )
A.0.15mol/L B.1.36mol/L C.5.07mol/L D.6.15mol/L
17.将KCl、KBr混合物13.4g溶于水配成500mL溶液,通入过量Cl2,反应后将溶液蒸干,得干燥固体11.175g,则原溶液中K+、Cl-、Br-的物质的量之比为( )
A.1∶2∶3 B.3∶2∶1 C.1∶3∶2 D.2∶3∶1
二、填空题
18.欲用实验方法证明KClO3中含有氯元素,可先取适量KClO3及少量 于试管中,充分加热后,再溶于适量蒸馏水并过滤,最后取滤液少许,滴加 溶液和 ,有白色沉淀生成,则说明KClO3中含Cl元素.写出有关反应的化学方程式: .
19.利用如下图装置收集以下气体:①H2、②Cl2、③CH4、④HCl、⑤HBr
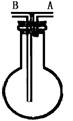
(1)若烧瓶是干燥的,由A进气可收集 ,由B进气可收集 .
(2)若烧瓶充满水可收集的气体是 气体应从 (A或B)口进入.
(3)如果烧瓶内装有一定量的某溶液,用以洗气,则气体应从 口进入.
20.已知漂白粉与浓盐酸反应产生氯气.某同学为了测定产生氯气的体积并验证干燥纯净的氯气干无漂白性,现有如下装置,请回答:(注Ca(ClO)2+4HCl(浓) = CaCl2+2H2O+2Cl2↑稀盐酸则不能)
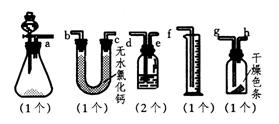
①请用字母填写装置的连接顺序:a接( )、( )接( )、( )接( )、( )接( )、( )接( ).
②洗气瓶中所装液体是
③在制氯气前,必须进行的一项操作步骤是
④某同学在实验中,发现量筒中未收集到液体,则失败的原因可能是 、 、 .
21.某固体混合物可能由KNO3、K2SO4、KI、NaCl、CuCl2、CaCl2和Na2CO3中的一种或几种组成.依次进行下列五步实验,观察到的现象记录如下:
①取一定量混合物加水溶解得无色透明溶液;
②向上述溶液中滴加BaCl2溶液,有白色沉淀生成,将该沉淀滤出,并将滤液分成两份;
③上述白色沉淀可完全溶解于稀盐酸中;
④往一份滤液中滴加氯水并加入CCl4,振荡后静置,CCl4层无色;
⑤往另一份滤液中加入AgNO3溶液,有白色沉淀生成,该沉淀不溶于稀硝酸.根据以上实验现象,可以判断出混合物中肯定含有 ;肯定不含有的物质是 ;不能判断混合物中是否含有的物质是 .
三、计算题
22.足量的浓盐酸与4.35gMnO2混合加热,向反应后的溶液中加入10.6g10%的Na2CO3溶液,恰好不再产生气体,再向溶液中加入过量的AgNO3溶液求:
①标准状况下产生Cl2的体积
②生成AgCl沉淀的质量
23.200mL密度为1.20g/cm3质量分数为24.5%的硫酸溶液跟足量的铁屑充分反应,计算:
(1)此硫酸的物质的量浓度.
(2)反应生成的H2在标准状况下的体积.
(3)将生成的FeSO4配制成500mL溶液时,FeSO4物质的量浓度为多少?
参考答案:
一、1.BD 2.A 3.D 4.C 5.BD 6.A 7.B 8.D 9.BD 10.B 11.D 12.A 13.D 14.B 15.A 16.C 17.B
二、18.MnO2;AgNO3;稀HNO3 2KClO3![]() 2KCl+3O2↑ KCl+AgNO3=AgCl↓+KNO3
2KCl+3O2↑ KCl+AgNO3=AgCl↓+KNO3
19.(1)1,3;2、4、5 (2)1、3;A (3)B
20.①d、e、b、c、g、h、e、d、f ②饱和食盐水 ③检查装置的气密性 ④.用的是稀盐酸;装置的气密性差;e直接与f相连.
21.Na2CO3;CuCl2、CaCl2、K2SO4、KI;KNO3、NaCl
三、22.①1.12L ②m(AgCl)=17.22g
23.(1)C(H2SO4)=3.0mol·L-1 (2)V(H2)=13.44L (3)C(FeSO4)=1.2mol·L-1