
2005-2006学年度下学期
高中学生学科素质训练
高一化学期末测试
说明:本试卷分第一卷和第二卷两部分,第一卷46分,第二卷54分,共100分;答题时间90分钟.
第I卷(共46分)
一、选择题(共8小题,每题2分,计16分,每小题只有一个正确答案)
1.每年6月5日是世界环境日,2005年我国环保总局确定的主题是“人人参与,创建绿色家园”。下列措施不符合这一主题的是 ( )
A.推广垃圾分类存放,分类回收,分类处理
B.将煤气化和液化,以提高煤的燃烧效率
C.推广使用液化石油气(LPG)替代汽油和柴油作公交车和出租车的燃料
D.将工厂的烟囱造高,以减少工厂周围的大气污染
2.2002年由德、法、美、英及波兰等多国科学家组成的科研小组,通过粒子加速进行了一周的实验,获得了6个非常罕见的Fe—45原子。接着,科学家又使用特制的测量仪器观测到,这6个原子中有4个发生了衰变,这一实验证实了曾预言的双质子衰变方式,即有一个原子同时放出两个质子的衰变方式。以下关于![]() 的说法正确的是( )
的说法正确的是( )
A.该原子的质子数与中子数之差为7 B.科学家们获得了一种新元素
C.![]() Fe与
Fe与![]() Fe化学性质不相同 D.这种铁原子衰变放出两个质子后变成
Fe化学性质不相同 D.这种铁原子衰变放出两个质子后变成![]() Fe
Fe
3.在空气中久置而不易变质的是 ( )
A.烧碱 B.泡花碱 C.纯碱 D.碱石灰
4.下列说法中,正确的是 ( )
A.碳是非金属元素,所以碳单质都是绝缘体
B.锗不存在气态氢化物
C.硅的导电性介于金属和绝缘体之间
D.锗的非金属性比金属性强
5.不慎误服BaCl2后,可服用的解毒剂是 ( )
A.CuSO4 B.Na2CO3 C.AgNO3 D.MgSO4
6.下列关于碳族元素及其化合物的性质描述不正确的是 ( )
A.除Pb外,+4价化合物是稳定的
B.RO和RO2(除CO2外)均不跟水反应
C.RH4的稳定性随着相对分子质量的增大而增大
D.RH4的沸点从碳到铅逐渐升高
7.为验证浓硫酸与碳反应的气体产物中含SO2和CO2,通常是让气体通过品红溶液,然后通过KMnO4溶液,最后通过澄清石灰水,在这过程中SO2和CO2表现出的性质是( )
①SO2的漂白性;②SO2的氧化性;③SO2的还原性;
④SO2酸性氧化物;⑤CO2酸性氧化物;⑥CO2的氧化性。
A.①③⑤ B.①②④⑤ C.②③⑤⑥ D.①④⑤⑥
8.下列实验中浓硫酸表现脱水性的是:①浓硫酸敞口久置于空气中增重;②浓硫酸干燥氢气;③浓硫酸使白纸变黑;④浓硫酸使蓝色硫酸铜晶体变白;⑤浓硫酸使铁、铝等金属钝化;⑥蔗糖中加入浓硫酸制“黑面包” ( )
A.②④⑤ B.③④⑤ C.③⑥ D.①③⑤
二、选择题(本题包括10小题,每小题3分,共30分。每小题有一至二个选项符合题意,少选扣1分,多选、错选均不给分)
10.下列各组离子在pH=1的溶液中,因发生氧化还原反应而不能大量共存的是 ( )
A.Na+、K+、CO32-、NO3- B.NH4+、Na+、SO32-、S2-
C.Al3+、Na+、MnO4-、I- D.CH3COO-、Cl-、Na+
11.元素周期表中前7周期的元素如下表所示:
| 周期数 | 1 | 2 | 3 | 4 | 5 | 6 | 7 |
| 元素数 | 2 | 8 | 8 | 18 | 18 | 32 | 32 |
请分析周期数与元素数的关系,然后预言第8周期最多可能含有的元素种数为( )
A.18 B.32 C.50 D.64
12.密闭容器中充入CO2和CO的混合气体,混合气体的平均相对分子质量为32,容器内压强为P,然后投入足量Na2O2,不断用电火花点燃至反应停止,恢复到原温度,容器内的压强为 ( )
A.P
B.![]() P
C.
P
C.![]() P
D.
P
D.![]() P
P
13.下列离子方程式正确的是 ( )
A.碳酸氢钙溶液中加盐酸:HCO3-+H+![]() CO2↑+H2O
CO2↑+H2O
B.碳酸氢钙溶液中加足量的氢氧化钠溶液:Ca2++OH-+HCO3-![]() CaCO3↓+H2O
CaCO3↓+H2O
C.稀硫酸和氢氧化钡溶液:Ba2++2 OH-+2
H++SO42-![]() BaSO4↓+2 H2O
BaSO4↓+2 H2O
D.水玻璃中通入过量二氧化碳:SiO32-+CO2+2H2O![]() CO32-+H4SiO4↓
CO32-+H4SiO4↓
14.某温度下,在100克水中加入m gCuSO4或加入n g CuSO4·5H2O,均可使溶液恰好达到饱和,则m与n的关系符合 ( )
A.![]() B.
B.![]() C.
C.![]() D.
D.![]()
15.下表是元素周期表的一部分。表中所列的字母分别代表某一化学元素。
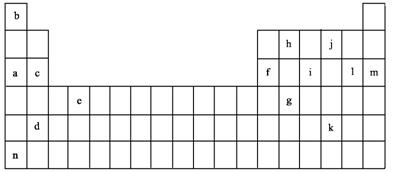 |
下列叙述中正确的是 ( )
A.字母l所代表的元素的最高价氧化物对应的水化物酸性最强
B.字母a、c、d、i所代表的元素形成的单质可能都是电的良导体
C.上表14种元素中n元素失去核外第1个电子需要的能量最多
 D.上表14种元素中m元素失去核外第1个电子需要的能量最少
D.上表14种元素中m元素失去核外第1个电子需要的能量最少
16.利用下列各组中物质作用制备和收集少量气体,能采用右图实验装置
的是( )
①锌和稀硫酸;②电石和水;③过氧化钠和水;④亚硫酸钠和硫酸;
⑤铜和稀硝酸;⑥浓硫酸和浓盐酸
A.仅仅③④⑥ B.④⑤ C.仅②③④⑤ D.全部
17.氢化铵(NH4H)与氯化铵的结构相似,已知NH4H与水反应有H2生成,下列叙述不正
确的是( )
A.NH4H是离子化合物,含有离子键和共价键
B.NH4H溶于水,所形成的溶液显碱性
 C.NH4H与水反应时,NH4H是氧化剂
C.NH4H与水反应时,NH4H是氧化剂
D.将NH4H固体投入少量水中,有两种气体产生
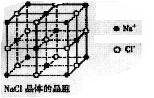
18.纳米材料的表面微粒占总微粒数的比例极大,这是它有许多特殊性质的原因。假设某氯化钠纳米颗粒的大小和形状恰好与氯化钠晶胞的大小和形状相同(如右图所示),则这种纳米颗粒的表面微粒数与总微粒数的比值为 ( )
A.7:8 B.13:14 C.25:26 D.26:27
第Ⅱ卷(共54分)
三、填空题(共5小题,计26分)
19.(7分)超重元素的假设预言自然界中可能存在114号的稳定同位素X,请根据原子结构理论和元素周期律预测:
(1)X元素位于周期表中第______周期,_______族,为______元素(金属或非金属)(2)写出其最高价氧化物及其水化物的化学式_______________、_____________,并估计后者为_____________(酸性或碱性)
(3)它与氯气反应生成的化合物的化学式为_________________。
20.(3分)原硅酸通过分子间缩水聚合可形成不同的多硅酸(多聚体),如:
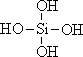
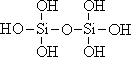
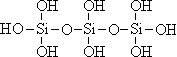
原硅酸 二聚体 三聚体
按上述规律,n个原硅酸聚合而成的链状多酸分子的通式是 。
21.(4分)(1)常用的农药石硫合剂是硫粉和石灰乳拌合而成的一种浊液。其反应很复杂,其中反应的主要产物为CaS2O3、CaS•Sx和H2O。写出该反应的化学方程式___________
_ ;在此反应中硫单质_______(填“是”或“否”)发生了氧化还原反应。
(2)工业上制CuSO4时,不是直接用铜跟浓硫酸在加热条件下反应,而是将铜丝浸入稀H2SO4中,再不断地从容器下部吹入细小的空气泡,这样做的好处是①__________ _ ,②____________ _。
22.(6分)不同元素的原子在分子内吸引电子的能力大小可用一定数值x来表示,若x越大,其原子吸引电子能力越强,在所形成的分子中成为带负电荷的一方。
下面是某些短周期元素的x值:
| 元素符号 | Li | Be | B | C | O | F | Na | Al | Si | P | S | Cl |
| x值 | 0.98 | 1.57 | 2.04 | 2.25 | 3.44 | 3.98 | 0.93 | 1.61 | 1.90 | 2.19 | 2.58 | 3.16 |
(1)通过分析x值变化规律,确定Mg、N的x值范围:
<x(Mg)< , <x(N)< 。
(2)推测x值与原子半径的关系是 。据据短周期元素的x值变化特点,体现了元素性质的 变化规律。
23.(6分)短周期元素A、B、C、D,它们的原子序数依次增大。其中A、C与B、D分别是同主族元素。又知B、D两元素的原子核中质子数之和是A、C两元素原子核中质子 数和的2倍。这四种元素的单质中有2种气体,2种固体。
(1)写出元素符号:A ;D ;
(2)写出两种均含有A、B、C、D四种元素的化合物相互作用逸出气体的离子方程
式 。
(3)A、C组成的化合物,常作为野外考察的取氢(H2)剂。试写出该化合物的电子式 ;该化合物中加入适量的水,即可形成氢气。写出制氢化学方程式 ;经研究发现,该化合物中加入某些单质(如:Si、Al),再加水,可以成倍地产生氢气。现取1mol该化合物中加入适量的单质硅,产生氢气 ____________mol。
 四、实验题(共2小题,计17分)
四、实验题(共2小题,计17分)
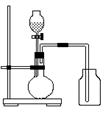
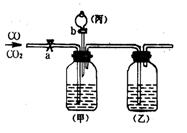
24.(9分)要分离一氧化碳、二氧化碳并分别得到干燥的气
体,某学生设计如右图装置,其中a、b是玻璃活塞。
(1)甲容器中盛______溶液;乙容器中盛_____溶液;
丙容器中盛_______溶液。
(2)实验时关闭_____(a、b),打开______(a、b),发
生反应的化学方程式是________________________,
这样得到的气体是__________________。
(3)当分离完一种气体后,关闭___,打开_____, 发
生反应的化学方程式是________________________________________,这样得到的气体是______________。
25.(8分)用石灰石和酸反应制取CO2气体,往往含有水蒸气、硫化氢、氯化氢、少量氧气等。为了得到干燥和较纯净的CO2,某学生设计了如下图的实验装置。所选用的试剂有浓硫酸、饱和碳酸氢钠溶液、硫酸铜溶液、铜网等。A是石灰石,G是收集干燥纯净的CO2的装置。
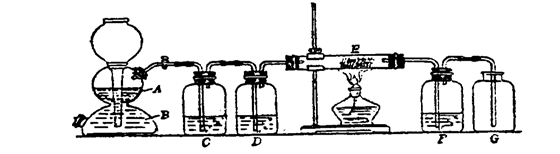
根据上述实验条件和要求回答下列各问:
(1)B物质是 ,E中盛放的是 。
(2)D洗气瓶中盛的是CuSO4溶液,除去杂质反应的离子方程式是
(3)C中盛的是 ,该装置反应的化学方程式 。
(4)F装置的作用是 ,所盛试剂是 。
(5)启普发生器中A与B反应产生CO2气体的离子方程式为 。
四、计算题:(计11分)
26.(5分)23.第四主族元素R,在它的化合物R(OH)n中,其质量分数为0.778,在它的另一种化合物R(OH)m中,其质量分数为0.636。
(1)试求n和m的值。
(2)试求R的相对原子质量。
27.(6分)密闭容器中将3.62 gNaOH、Na2S、Na2SO3的混合物溶于50 mL某浓度的稀 H2SO4
中,不放出任何气体,再加入100 mL 0.1mol·L-1的Ba(OH)2溶液,正好中和过量的
H2SO4。将反应所得沉淀分离、洗净、烘干、称重,其质量为3.29 g 。求:
(1)原混合物中各物质的物质的量之比;
(2)原稀H2SO4的物质的量浓度。
参考答案
一、选择题
1.D 2.A 3.C 4.C 5.D 6.B 7.A 8.C
二、选择题
10.BC 11.C 12.D 13. A C 14. B 15. A 16.A 17.C 18.D
三、填空题
19.(1)七, IVA族,金属 (2)XO2、X(OH)4、碱性 (3)X+2Cl2==XCl4
20.H2n+2SinO3n+1
21.(1)2(x+2)S+3Ca(OH)2![]() CaS2O3+2CaS•Sx+3H2O;是
CaS2O3+2CaS•Sx+3H2O;是
(2)①减少硫酸的用量;②不会产生对大气污染的SO2
22.(1)0.93 1.61 2.25 3.44
(2)同周期(同主族)中,x值越大,其原子半径越小 周期性
23.(1)H、S(2,)(2)HSO3-+H+![]() SO2+H2O(2,)
(3)
SO2+H2O(2,)
(3)
(4)Na+[H:] -(2,);NaH+H2O![]() NaOH+H2(2,);2(1,)
NaOH+H2(2,);2(1,)
四、实验题
24.(1)氢氧化钠溶液(符合题意的其它物质均可,下同) 浓硫酸 稀硫酸
(2)b aCO2+NaOH![]() Na2CO3 一氧化碳
Na2CO3 一氧化碳
(3)a b
Na2CO3+H2SO4![]() Na2SO4+CO2↑+H2O 二氧化碳
Na2SO4+CO2↑+H2O 二氧化碳
25.(1)盐酸;铜网 (2)H2S+CuSO4![]() CuS¯+2H+
CuS¯+2H+
(3)饱和碳酸氢钠溶液;![]() +H+
+H+![]() H2O+CO2 (4)干燥CO2气体;浓硫酸
H2O+CO2 (4)干燥CO2气体;浓硫酸
(5) CaCO3+2H+![]() Ca2++H2O+CO2
Ca2++H2O+CO2
五、计算题
26.解:(1)由质量分数的含义可列方程组:
a:(a+17n)=0.778 ①
a:(a+17m)=0.636 ②
由①和②可解得n:m=1:2
由于R为碳族元素,所以其主要化合价有+2,+4价,即其氢氧化物只有两种形式:R(OH)2和R(OH)4,所以n=2,m=4
(2)将n=2 代入①式,或将m=4代入②式,解得a=119
27.解:(1)2Na2S+Na2SO3+3H2SO4![]() 3S↓+3Na2SO4+3H2O,
3S↓+3Na2SO4+3H2O,
H2SO4+Ba(OH)2![]() BaSO4↓+3H2O,由题意知:(Na2S):Na2SO3=2:1
BaSO4↓+3H2O,由题意知:(Na2S):Na2SO3=2:1
设NaOH为y, Na2S为2x ,Na2SO3为x有:
![]()
∴NaOH:Na2S:Na2SO3=0.020:0.02 :0.01=2 :2 :1
(2)SO42-守恒,最终溶液中为BaSO4:2.33g为0.1mol
Na元素守恒:NaOH:0.02mol, Na2S:0.02mol , Na2SO3:0.01mol
∴n(Na)=0.02+0.02×2+0.01×2=0.08mol
∴n(Na2SO4)=0.04mol, ∴C(H2SO4)=
![]() = 0.8mol/L
= 0.8mol/L
答:略。