安阳市二中
2005~2006学年度第二学期期中试题
高一化学试卷
本试卷分第Ⅰ卷和第Ⅱ卷,第Ⅰ卷为选择题,共45分,第Ⅱ卷为非选择题,共55分,满分阶段100分,考试时间100分钟,将第Ⅰ卷选择题的答案卡中。
可能用到的相对原子质量:H:1 Mg:24 C:12 O:16 S:32
Cl:35.5 Br:80 Na:23 Al:27 K:39 Fe:56 Cu:64 Ag:108
第Ⅰ卷(共45分)
一、选择题(本题包括15小题,每小题2分,共30分,每小题只有一个选项符合题意)
1、在化学反应中,构成原子的各种微粒会发生变化的是( )
A、质子数 B、中子数 C、电子数 D、质量数
2、氢原子的电子云图中的小黑点表示的意义是( )
A、一个小黑点表示一个电子
B、黑点的多少表示电子个数的多少
C、表示电子运动的轨迹
D、电子在核外某空间出现机会的多少
3、在下列元素中,最高正化合价数值最大的是 ( )
A、Na B、P C、Cl D、Ar
4、短周期元素中,最外层电子数是内层电子总数的一半的元素有
A、1种 B、2种 C、3种 D、4种
5、下列说法不正确的是 ( )
A、含有共价键的化合物一定是共价化合物
B、在共价化合物中一定有共价键
C、含有离子键的化合物一定是离子化合物
D、双原子单质分子中的共价键一定是非极性共价键
6、阴离子Xn-含中子N个,X的质量数为A,则m g X元素的气态氢化物中含质子的物质的量是( )
A、![]() B、
B、![]()
C、![]() D、
D、![]()
7、下列物质中互为同素异形体的是
A、126 C和146 C B、氧气和臭氧
C、水和双氧水 D、CO和CO2
8、下列性质的排列顺序正确的是
A、稳定性:H2O>H2S>H2Se
B、酸性:H2SeO4>H2SO4>H2TeO4
C、氧化性:S>Cl2
D、还原性:S>P
9、未做实验而欺骗老师的学生是
A、老师,我用Na2SO3溶液与BaCl2作用,有白色沉淀生成,加入稀盐酸后沉淀消失.
B、老师,我向Ba(OH)2溶液中通入SO2气体,有白色沉淀生成.
C、老师,我向NaHSO4溶液中加入BaCl2溶液,出现白色沉淀,加入稀盐酸沉淀也不消失.
D、老师,我向BaCl2溶液中通入SO2气体也出现白色沉淀.
10、在①氯水 ②浓盐酸 ③活性炭 ④漂白粉 ⑤双氧水 ⑥二氧化硫等6种物质中,能使品红溶液褪色的是
A、①④⑥ B、②③④
C、①③④⑥ D、①③④⑤⑥
11、某二价阴离子具有18个电子,原子核内有16个中子,则它的质量数为( )
A、34 B、32 C、18 D、16
12、下列物质中,既有离子键,又有共价键的是( )
A、CaCl2 B、H2SO4 C、H2O D、NH4F
13、下列各组微粒具有相同质子数和电子数的是( )
A、CH4 NH3 Na+ B、OH― F― NH3
C、H3O+ NH4+ Na+ D、O2― OH― NH4+
14、利用废铜屑制取CuSO4溶液最好的方法是
A、铜屑和浓硫酸混和加热
B、铜屑在空气中灼烧后再溶于稀H2SO4
C、铜屑和稀硫酸混和加热
D、铜屑在空气中灼烧后再溶于浓H2SO4
15、质子论认为,凡能给出质子的分子或离子都是酸,凡能结合质子的分子或离子都是碱,依此理论,下列分子或离子既是酸又是碱的是( )
A、CO32― B、NH3 C、HCO3― D、HCl
二、选择题(本题包括5小题,每小题3分,共15分,每小题只有一个选项符合题意。)
16、短周期元素A与B能形成A2B3化合物,若A的原子序数为m,则B的原子序数不可能是( )
A、m+3 B、m+4 C、m+11 D、m-5、
17、有aXn-与bYm+两种微粒,它们电子层结构相同,则下列关系式正确的是( )
A、a-n= b + m B、a + n=b-m
C、b<a D、a + n>b
18、氧气在放电条件下,若有30%转化为臭氧,当温度和压强相同时,放电前后气体的密度之比是
A、10:9 B、9:10 C、3:2 D、2:3
19、将90%的H2SO4与10%的H2SO4溶液等体积混合,所得溶液质量分数为
A.等于50% B.小于50%
C.大于50% D.不能确定
20、t℃时某CuSO4溶液加入14.2g无水CuSO4粉末或投入25g CuSO4·5H2O晶体,均完全溶解得其饱和溶液,则t℃时CuSO4溶解度为
A.20g B.43.2g C.120g D.158g
| 题号 | 三 | 四 | 五 | 总分 |
| 分数 |
第Ⅱ卷(共55分)
三、填空题(本题共30分)
21、氧族元素包括氧、硫、 、 (名称)。随着原子序数的增大,它们的原子半径逐渐 ,非金属性逐渐 。
22、下表为元素周期表的一部分,列出10种元素在元素周期表中的位置。
|
周期 | Ⅰ | Ⅱ | Ⅲ | Ⅳ | Ⅴ | Ⅵ | Ⅶ | 0 |
| 2 | ⑥ | ⑦ | ||||||
| 3 | ① | ③ | ⑤ | ⑧ | ⑩ | |||
| 4 | ② | ④ | ⑨ |
用化学符号回答下列各问题:
(1)10种元素中,化学性质最不活泼的是 ;金属性最强的是 (元素符号)。
(2)①、③、⑤三种元素最高价氧化物对应的水化物中,碱性最强的是 (化学式)
(3)②、③、④三种元素形成的离子,离子半径由大到小的顺序是
(4)元素⑦的氢化物常温下和元素②的单质反应的化学方程式为 ;
(5)①和⑨两元素形成化合物的电子式为 ;该化合物灼烧时的焰色为 色;该化合物的溶液与元素⑧的单质反应的化学方程为
。
(6)①和⑤最高价氧化物对应的水化物相互反应的离子方程式为
23、将下列变化中浓硫酸表现的性质填在空格内.
(1)浓H2SO4与Na2SO3反应
(2)浓H2SO4灼伤皮肤
(3)浓H2SO4常温下不与铁、铝反应
24、在通常状况下,A为固体单质,根据下列转化关系,回答
(1)写出A—E的化学式:
A B C D E
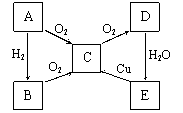 (2)写出指定反应的化学反应方程式:
(2)写出指定反应的化学反应方程式:
①B→C:
②E→C:
③C→D:
四、实验题(15分)
25、根据如图所示回答问题:
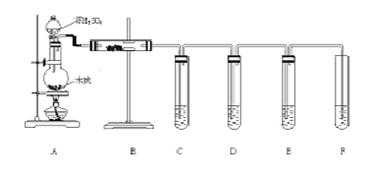
(1) 上述装置中,在反应前用手掌紧贴烧瓶外壁检查装置的气密性,如观察不到明显的现象,还可以用什么简单的方法证明该装置不漏气。
答: ;
(2) 写出浓硫酸和木炭粉在加热条件下发生反应的化学方程式:
答: ;
(3) 如果用图中的装置检验上述反应的全部产物,写出下面标号所表示的仪器中应加入的试剂的名称及其作用:
B中加入的试剂是 ,作用是 ;
C中加入的试剂是 ,作用是 ;
D中加入的试剂是 ,作用是除尽 气体;
E中加入的试剂是 ,作用是 ;
(4)F装置的作用是 ,反应的化学方程式是
。
四、计算题(本题共1小题,10分)
26、用铜与浓硫酸,得到二氧化硫的体积为2.24L(标准状况)。试计算:
(1)被还原的硫酸的物质的量
(2)把所得的硫酸铜配成500mL溶液,所得溶液的物质的量浓度是多少?
高一化学答案
一、选择题(30分)
| 题号 | 1 | 2 | 3 | 4 | 5 | 6 | 7 | 8 |
| 答案 | C | D | C | B | A | C | B | A |
| 题号 | 9 | 10 | 11 | 12 | 13 | 14 | 15 | |
| 答案 | D | D | B | D | C | C | C |
二、选择题(15分)
| 题号 | 16 | 17 | 18 | 19 | 20 |
| 答案 | B | B | B | C | A |
三、填空题(本题共30分)
21、硒,碲,减小,减弱(4分)
22、(1)Ar、K (2)NaOH (3)K+>Ca2+>Mg2+
(4)2K+2H2O=2KOH+H2↑ (5)KBr的电子式 ,紫色,2KBr+Cl2=2KCl+Br2 (6)Al(OH)3+OH-=AlO2-+2H2O(12分)
23、强酸性、脱水性、强氧化性(3分)
24、硫,硫化氢、二氧化硫、三氧化硫、硫酸
方程式略(11分)(每空1分,方程式2分)
四、实验题(15分)
25、(1)用酒精灯微热(和理都可给分)(2分)
(2)略
(3)无水硫酸铜,检验水蒸汽
(4)品红,检验二氧化硫
(5)酸性高锰酸钾,除去二氧化硫
(6)品红,检验二氧化硫被除尽了
(7)检验二氧化碳,方程式略根据如图所示回答问题
四、计算题(本题共1小题,10分)
26、0.1mol(5分),0.2mol/l