高一化学必修1第三章《金属及其化合物》单元测试题(A卷)
可能用到的原子量:
H 1 O 16 Na 23 Mg 24 Al 27 Cl 35.5
Fe 56 Cu 64 Zn 65
一、选择题:( 本题有14个小题,每小题有1~2选项符合题意,每小题4分,共56分。)
( )1.下列物质中不属于合金的是
A.硬铝 B.钢铁 C.青铜 D.金箔
( )2.把一小块钠投入盛有煤油和水的烧杯中,可以观察到的现象是
A.钠浮在烧杯中的液面上 B.钠沉在烧杯的底部
C.钠会在水和煤油的交界面上下浮动,直到反应结束
D.煤油会燃烧起来,产生很浓的黑烟
( )3.下列各组物质的稀溶液相互反应,把前者逐滴滴入后者与把后者逐滴滴入前者,所产生的现象不相同的是
A.AlCl3 和NaOH B.Na2CO3和HCl
C.NaHCO3和HCl D.NaCl和AgNO3
( )4.世界组织把铝确定为食品污染源之一,应加以控制使用。铝在下列应用时应加以控制的是 ①制铝合金 ②制电线 ③制炊具 ④明矾净水 ⑤明矾与苏打制食品膨松剂 ⑥用氢氧化铝凝胶制胃舒平药片 ⑦银色漆颜料 ⑧易拉罐 ⑨包装糖果和小食品
A.③⑤⑧⑨ B.①②⑥⑧⑨ C.③⑤⑨ D.③④⑤⑥⑧⑨
( )5.将适量铁粉放入FeCl3溶液中,完全反应后,溶液中的Fe2+和Fe3+溶度相等,则已反应的Fe3+和未反应的Fe3+的物质的量之比是
A.2 :3 B.3 :2 C.1 :2 D.1 :1
( )6.下列关于金属的叙述中正确的是
A. 常温下所有的金属都是固态
B. 金属具有导电、导热和延展性
C. 金属元素的原子只有还原性,离子只有氧化性
D. 金属元素大多数以化合态存在于自然界
( )7.下列变化不可能通过一步实验直接完成的是
A.Al(OH)3 → Al2O3 B.Al2O3 → Al(OH)3
C.Al → AlO2- D. Al3+ → Al(OH)3
( )8.某溶液能溶解Al(OH)3,则此溶液中一定能大量共存的离子组是
A.Mg2+ 、Cl-、Na+、NO3- B.K+、Na+、NO3-、HCO3-
C.Na+、Ba2+、Cl-、NO3- D.Fe3+、Na+、AlO2-、SO42-
( )9.能证明某溶液中含有Fe2+的是
A.该溶液呈浅绿色
B.该溶液中加入NaOH溶液,生成白色沉淀并迅速变成灰绿色,最后变为红褐色
C.向该溶液中加入氯水,再滴入几滴KSCN溶液,呈红色
D.向该溶液中滴入几滴KSCN溶液,不变色,再加入氯水,呈红色
( )10.下列反应的离子方程式正确的是
A.铝粉投入到NaOH溶液中:2Al +2OH- = 2AlO2- + H2↑
B.铁粉加入三氯化铁溶液中:2Fe +Fe3+ = 3Fe2+
C.AlCl3溶液中加入足量的氨水:Al3+ + 3OH- = Al(OH)3↓
D. FeCl2溶液中加入氯水:Cl2 +2 Fe2+ =2 Fe3+ + 2Cl-
( )11.密闭容器中装有1mol NaHCO3和0.8mol Na2O2,加热充分反应后,容器内残留的固体是
A.0.8molNa2CO3和0.6molNaOH B.0.5molNa2CO3和1molNaOH
C.0.8molNa2CO3和1molNaOH D.1molNa2CO3和0.6molNaOH
( )12.把a g 铝铁合金粉末溶于足量盐酸中,再加入过量氢氧化钠溶液。过滤出沉淀,经洗涤、干燥、灼烧,得到红棕色粉末的质量仍为a g,则此合金中铝的质量分数为
A.70% B.30% C.52.4% D.22.2%
( )13.能说明一定是金属元素的事实是
A. 原子最外层只有1个电子的元素
B.在化学反应中能失去电子的原子
C. 在化合物中只有正价没有负价的元素
D.能跟非金属反应的物质
( )14.既能跟盐酸反应又能跟NaOH溶液反应的化合物是
A.Al B.Al2O3 C.Na2CO3 D.NaHCO3
二、非选择题(共44分)
15. (12分)下列四种鉴别无水碳酸钠和碳酸氢钠的方法是否可行?可行的写出实验现象及结论,不可行的说明理由
(1)2支试管中分别放入约1g 的两种试样,分别滴入10 滴水
。
(2)将试样配成物质的量浓度相同的溶液,分别滴入数滴酚酞
。
(3)2支试管中分别放入约1g 的两种试样,分别加热
。
(4)2支试管中分别放入约1g 的两种试样,分别加入足量的稀盐酸
。
16.(12分)A、B、C、D、F五种物质的焰色反应均为黄色,A、B、C、D与盐酸反应均生成E,此外B还生成一种可燃气体。而C、D还生成一种无色无味气体H,该气体能使澄清石灰水变浑浊。D和A可反应生成C,F和H也可反应生成C和另一种无色无味气体。请回答下列问题:
(1)写出A、B、C、D、E、F的化学式
。
(2)写出F和H反应的化学方程式 。
(3)写出下列反应的离子方程式:
① D+盐酸 。
② B+水 。
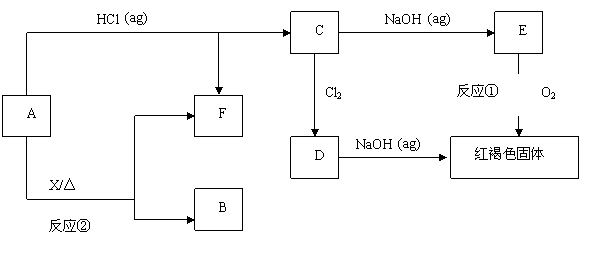 17.(8分) 已知A为金属单质,它们之间能发生如下反应(部分产物未标出)
17.(8分) 已知A为金属单质,它们之间能发生如下反应(部分产物未标出)
请根据以上信息回答下列问题:
(1)写出物质B、D的化学式:
(2)写出下列反应的化学方程式:
反应①
反应②
18.(8分)现有浓度各为1mol·L-1的FeCl3、FeCl2、CuCl2混合溶液100mL,加入一定量的铁粉,对下列各情况填空(已知:氧化性Fe3+ > Cu2+ > Fe2+ )。
(1) 反应完毕,铁粉有剩余。反应后的溶液中一定含 阳离子。
(2) 反应完毕,有铜生成,铁粉无剩余。反应后的溶液中一定含 阳离子,该阳离子在溶液中物质的量的范围是 ;反应后的溶液中可能含 阳离子。
(3) 反应完毕后,无固体沉积物存在,反应后的溶液中一定含 和 阳离子。
19.(6分) 现有FeCl3、AlCl3的混合溶液100mL,逐滴加入NaOH溶液,生成沉淀的物质的量随加入的NaOH的物质的量的关系如图,请计算出FeCl3、AlCl3的物质的量浓度各为多少?
 |
第三章(A卷)测试题参考答案
一、选择题(每小题4分,共56分。)
| 题号 | 1 | 2 | 3 | 4 | 5 | 6 | 7 | 8 |
| 答案 | D | C | AB | D | A | BD | B | C |
| 题号 | 9 | 10 | 11 | 12 | 13 | 14 | ||
| 答案 | BD | D | D | B | C | BD |
二、非选择题(共44分)
15.(每小题3分)(1)可行,粉末粘结且放热的是Na2CO3,粉末部分成溶液的为NaHCO3。
(2)可行,溶液的红色较深的是Na2CO3,较浅的为NaHCO3。
(3)可行,试管壁有水珠的是NaHCO3,无明显变化的为Na2CO3。
(4)不可行,都有气体产生且产生气体的速率的差别甚小,难以作出正确判断。
16.(1)(各1分)A、NaOH B、Na C、Na2CO3 D、NaHCO3 E、NaCl F、Na2O2
(2)写出F和H反应的化学方程式 2Na2O2+2CO2=2Na2CO3+O2 。
(3)写出下列反应的离子方程式:
① D+盐酸 HCO3- + H+ = CO2↑ + H2O 。
② B+水 2Na + 2H2O = 2Na+ + 2OH- + H2 ↑ 。(每条方程式各2分)
17.(8分)(1)写出物质B、D的化学式:B:Fe3O4 D:FeCl3
(2)写出下列反应的化学方程式:
|
反应② 3Fe + 4H20(g) === Fe3O4 + 4H2 (各2分,共8分)
18.(离子各1分,计算3分)
(1) Fe2+ (2) Fe2+ 0.25mol< n(Fe2+)≤0.35mol Cu2+
(3) Fe2+ Cu2+ (离子顺序无先后)
19.(6分)FeCl3、AlCl3的物质的量浓度各为4mol/L、6mol/L(要写出规范的计算过程)