寿昌中学《物质结构 元素周期律》单元测试题
可能用到的相对原子质量:H—1,C—12,N—14,O—16,A—27,S—32
一、单项选择题
1. 下列属于同位素的一组是( )
A. 水和重水 B. Na2O和Na2O2 C. 氕、氘、氚 D. 40K、40Ca
2.同种元素的不同微粒,它们的( )
A.核外电子数一定相等 B.中子数一定相等
C.质子数一定相等 D.化学性质不一定相同
3.下列各组微粒中,质子数和电子数均相等的是( )
A.Na+和He B.H2O和D2O C.NH4+和NH3 D.H2SO4和HPO3
4. 一种比黄金贵百倍的818O2气体,不久前在兰州近代物理研究所制备成功。1mol818O2气体中所含中子的物质的量为( )
A.10mol B.18mol C.20mol D.36mol
5.下列微粒的核外电子排布错误的是( )
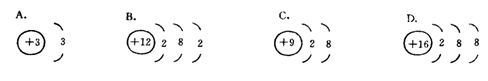
6.有A、B两种原子,A原子M层比B原子M层少3个电子,B原子L层电子数恰好是
A原子L层的两倍,则A元素是( )
A.O B.Si C.C D.Mg
7.A原子的L层比B原子L层少3个电子,B原子核外电子总数比A原子多5个,由此AB可形成( )
A.离子化合物B2A3 B.离子化合物B3A2 C.共价化合物B3A2 D.共价化合物B2A3
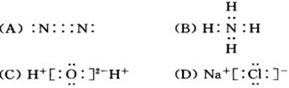
8. 下列电子式中,正确的是( )
9.已知A2-离子共含有x个中子,A元素的质量数为m,则n克A2-离子共含有电子的物
质的量为( )
A.![]() B.
B.![]() C.
C.![]() D.
D.![]()
10. 下列化合物中,既有离子键,又有共价键的是( )
A. Na2O2 B. NH3 C.CaCl2 D. HCl
11. 短周期元素X和Y能形成XY4化合物,若X的原子序数为m,Y的原子序数为n,则m和n不可能的关系是:( )
A.m-13=n B.n+5=m C.m+n=8 D.n-11=m
12. 元素性质呈周期性变化的决定因素是( )
A.元素原子半径大小呈周期性变化 B.元素原子量依次递增
C.元素原子最外层电子排布呈周期性变化 D.元素的最高正化合价呈周期性变化
13. 某主族元素R的最高正价与最低负化合价的代数和为4,由此可以判断( )
A.R一定是第四周期元素 B.R一定是ⅣA族元素
C.R的气态氢化物比同周期其他元素气态氢化物稳定
D.R气态氢化物化学式为H2R
14. 下列关于物质性质变化的比较, 正确的是( )
A. 酸性强弱: HI<HBr<HCl<HF B. 原子半径大小: Na > S > O
C. 碱性强弱: KOH<NaOH<LiOH D. 还原性强弱: F- > Cl- > I-
15.下列叙述正确的是( )
A.分子是由一定数目的原子组成的,原子之间的相互作用叫化学键
B.按C、N、O、F的顺序,元素的最高正价依次升高
C.非金属元素之间构成的化合物都不是离子化合物
D.离子化合物中一定含有离子键
16. 氢化钠(NaH)是一种白色的离子化合物,其中钠元素为+1价,NaH与水反应生成氢气,下列叙述正确的是( )
A. NaH在水中显酸性 B. NaH中氢离子半径比锂离子相等
C. NaH中氢离子电子排布与氦原子相同 D. NaH中氢离子可以被还原成氢气
17. 关于周期表和周期律,下列说法中正确的是( )
A. 在周期表中,元素的族序数都等于其原子的最外层电子数
B. VIIA组元素的单质,随相对分子质量的增大,熔、沸点升高;IA族单质,由上至下, 随相对原子质量递增,熔、沸点下降
C.周期表中非金属性最强的元素,其最高价氧化物的水化物酸性也最强
D. 同主族元素随原子核电荷数的递增,原子半径依次增大
18.有xn-、yn+、Z三种微粒,其电子层结构相同,下列分析中正确的是( )
A.微粒半径大小关系是x>y B.z一定是稀有气体元素
C.原子序数关系是z>y>x D.微粒半径关系是xn-<yn+
19.有A、B、C、D四种主族元素,A、B元素的阳离子和C、D元素的阴离子都具有相同的电子层结构,且A的阳离子氧化性比B的氧化性弱,C的阴离子所带负电荷比D的阴离子所带负电荷多,则A、B、C、D的原子序数大小关系是( )
A.B>A>C>D B.C>B>A>D D.A>B>C>D D.B>A>D>C
20. 同周期的X、Y、Z三种元素,已知其最高价氧化物对应的水化物的酸性强弱顺序是:
HXO 4>H2YO4>H3ZO4,则下列各判断中正确的是( )
A.原子半径:X>Y>Z B.单质的非金属性:X>Y>Z
C.气态氢化物稳定性:X<Y<Z D.原子序数:Z>Y>X
21.两种微粒的核外电子数相同,核电荷数不同,则它们可能是( )
A.两种不同元素的原子 B.一定是两种不同的离子
C.同一元素的原子和离子 D.两种不同元素的原子和离子
22.下列叙述中,正确的是( )
A. 39K+和40Ca2+微粒中的质子数、电子数和中子数都相等
B. D2和He在同温同压时,若体积相等,则质量不相等
C. 原子的最外层电子数相同的主族元素,化学性质一定相似
D.最外电子层(L层)上只有一个电子的原子和最外电子层(M层)上也只有一个电子
 的原子,它们彼此的化学性质一定相似
的原子,它们彼此的化学性质一定相似
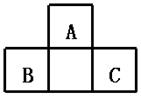
23. A、B、C均为短周期元素,它们在周期表中的位置如右图.已知B、C两元素在周期表中族序数之和是A元素族序数的2倍;B、C元素的原子序数之和是A元素原子序数的4倍,则A、B、C 所在的一组是( )
A.A.Be、Na、Al B.B、Mg、Si C.O、P、Cl D.C、Al、P
24. 能说明A元素非金属性比B元素非金属性强的是( )
A. A原子得到电子的数目比B原子少
B. A元素的最高正价比B元素的最高正价要高
C. 气态氢化物溶于水后的酸性:A比B强
D. A单质能与B的氢化物水溶液反应,生成B单质
25. A、B、C、D、E是同一周期的五种主族元素,A和B的最高价氧化物对应的水化物均呈碱性,且碱性B>A,C和D的气态氢化物的稳定性C>D;E是这五种元素中原子半径最小的元素,则它们的原子序数由小到大的顺序是( )
A.A、B、C、D、E B.E、C、D、B、A C.B、A、D、C、E D.C、D、A、B、E
二、填空题
26.在下列原子(或离子)结构简图上表示的微粒中(用元素符号填空)
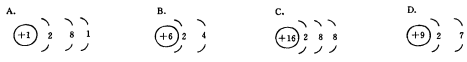
(1)半径最小的是 ;(2)具有最低负化合价的是 ;(3)只有还原性的是 ;(4)只有氧化性的是 ;(5)得失电子能力均最弱的是 .
27.10克重水中含有 个中子.同物质的量的H2O、D2O、T2O三种水的质量比为
 .
.
28. A、B、C、D四种短周期元素,原子序数D>A>B>C,且A、B同周期,C、D同主族,A的原子结构示意图如右图, B、C可形成离子化合物B3C2,据此填空:
(1)A的元素名称为 ,其气态氢化物的化学式为 。
(2)A、B、C、D四种元素的原子半径由小到大的顺序为(用元素符号) 。
(3)B和C最高价氧化物的水化物化学式分别为 和 。
29.现有A、B、C、D、E五种主族元素,其中A、C、D、E为短同期元素,A的最高价氧化物中含A40%,A原子中质子数等于中子数;B是第四周期中除稀有气体外原子半径最大的元素;B和D能形成BD型离子化合物 ,且B、D两离子的电子层结构相同;C和D能形成CD3的化合物;C原子比E原子多1个电子; 1.8gC与足量的稀H2SO4反应,所产生的氢气在标准状况下的体积为2.24L;C原子中质子数比中子数少1;D原子比A原子多1个质子.则:
(1)A、B的元素符号分别为:A ,B
(2)五种元素中,单质还原性最强的是 ,简单离子还原性最强的是 .
(3五种元素最高价氧化物对应水化物中酸性最强的是 ,碱性最强的是 .
(4)D单质与B的最高价氧化物的水化物反应的离子方程式 .
![]() 30.下表是元素周期表的一部分
30.下表是元素周期表的一部分
| 族 周期 | ⅠA | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅦA | O |
| 1 | ||||||||
| 2 | D | |||||||
| 3 | B | C | F | E | ||||
| 4 | A |
(1)写出单质的化学式:B 、D 、E ;
⑵ A核外电子排布为 ,C离子的电子式 ,D-和B+的电子层结构都与 电子层结构相同;
(3)AD2、HD电子式 ,F最高价氧化物的化学式 ;
(4)能生成两性氢氧化物的元素是 ,其最高价氧化物对应水化物与强碱溶液反应的离子方程式 .
31. 将某文献资料上记载的相对原子质量数据摘录如下:
|
| 34.969 | 75.77% |
| 35 | 75.77% |
|
| 36.969 | 24.23% |
| 37 | 24.23% |
| 平均 | 35.453 | 平均 | 35.485 | ||
试回答下列问题:(1)34.969表示______;(4)35.485是表示______.
32. 9.6g元素A与4.2g元素B含有相同的原子数,A和B原子核中质子数与中子数相等,已知A元素在其最高价氧化物中的含量是40%,在其氢化物中含量为94.1%。推算出A、B在周期表中的位置。
三、计算题
33.有相对原子质量均大于10的A、B两种元素,它们之间可形成化合物X和Y.已知等物质的量的X和Y的混合物的密度是相同条件下H2密度的18.5倍,其中X与Y的质量比为3∶4.4,经测定X的组成为AB,Y的组成为A2B.试通过计算确定A、B是什么元素.
34. 某核素ZAX的氯化物XCl21.11g配成溶液后,需用1mol/L的硝酸银溶液20mL才能把氯离子完全沉淀下来,试计算:
⑴X的质量数。
⑵若X的核内中子数为20,求37gXCl2中所含质子的物质的量是多少?
寿昌中学《物质结构 元素周期律》![]()
 试题答题卷
试题答题卷
一、单项选择题(每题2分,共50分)
| 题号 | 1 | 2 | 3 | 4 | 5 | 6 | 7 | 8 | 9 | 10 | 11 | 12 | 13 |
| 答案 | |||||||||||||
| 题号 | 14 | 15 | 16 | 17 | 18 | 19 | 20 | 21 | 22 | 23 | 24 | 25 | |
| 答案 |
二、填空题(共40分)
26.(每空各1分,5分)
27.(4分) ,
28.(每空各1分,5分)
⑴ ,
⑵
⑶ ,
29.(每小题各2分,8分)
⑴A B
⑵
⑶
⑷
30.(14分)
⑴(每空各1分)B ,D ,E
⑵(每空各1分)A ,C离子 ,
⑶(每空各2分)
⑷(每空各2分)
31.(2分) ,
32.(2分)A ,B
三、计算题(每题各5分,10分)
33.
34.
寿昌中学《物质结构 元素周期律》参考答案
一、选择题
1.C 2.D 3.B 4.C 5.A 6.C 7.B 8.D 9.B 10.A 11.C 12.C 13.D 14.B 15.D 16.C 17.D 18.B 19.D 20.B 21.D 22. D 23.C 24.D 25.C
二、填空题
26.(1)F (2)C (3)Na、S2- (4)F (5)C
27.3.01×1024;9:10:11
28. (1)硅,SiH4 (2)N<P<Si<Mg (3)Mg(OH)2 HNO3
29. (1)S、K
 (2)K、S2-
(2)K、S2-
(3)HClO4、KOH
(4)Cl2+2OH‑ ==Cl-+ClO‑+H2O
30.(1)B:Na D:F2 E:Ar (2) ;Al3+ ;Ne原子
![]()
Cl2O7
(4)Al; Al(OH)3+OH- == AlO2-+2H2O
31.(1)表示同位素![]() 的相对原子质量 (2)表示氯元素的近似相对原子质量
的相对原子质量 (2)表示氯元素的近似相对原子质量
32.解:设该氢化物为:HxA,该最高价氧化物分子式应该为:A2O8-x
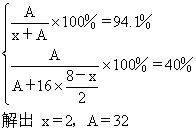
由于9.6g元素A与4.2g元素B含有相同的原子数,设B的原子量为y
由 ![]()
A的相对原子质量是32,其中子数与质子数相等,因此质子数为16的是硫元素,在第三周期ⅥA族。 B的相对原子质量是14,其中子数与质子数相等,因此质子数为7的是氮元素,在第二周期ⅤA族。
三、计算题
33解: A——NB——O
34.解: (1)40 (2)18mol