江海中学高一化学第四章《非金属及其化合物》单元测试题
班级 学号 姓名 得分
(满分100分)
一、选择题(本题含10小题,每题5分,共50分。)
1.将足量的CO2通入下列溶液中,能产生沉淀的是A
A.硅酸钠溶液 B.石灰水 C.氯化钡溶液 D.氯化钙溶液
2.将表面已完全钝化的铝条,插入下列溶液中,不会发生反应的是 ( )
A.稀硝酸 B.稀盐酸 C.浓硝酸 D.氢氧化钠
3.新制氯水与久置的氯水相比较,下列结论不正确的是A
A.颜色相同 B.前者能使有色布条褪色
C.都含有H+ D.加AgNO3溶液都能生成白色沉淀
4.漂白粉的有效成分是A
A.次氯酸钙 B.氯化钙 C.次氯酸 D.次氯酸钙与氯化钙
5.下列气体不能用H2SO4干燥的是 ( )
A. CO2 B.NH3 C. SO2 D. HC1
6.自来水可用氯气消毒,某学生用这种自来水去配制下列物质溶液,会产生明显的药品变质问题的是B
A.NaNO3 B.FeCl2 C.Na2SO4 D.AlCl3
7.亚硝酸(HNO2)参加反应时,既可作氧化剂,也可作还原剂。当它作还原剂时,可能生成的产物是D
A.NH3 B.N2 C.N2O3 D.HNO3
8..下列离子方程式,正确的是 ( )
A.澄清石灰水中通入过量二氧化碳:Ca2+ +2OH- +CO2 ===CaCO3↓+H2O
B.碳酸钠溶液中加入二氧化硅:CO32- +SiO2==SiO32- +CO2↑
C.二氧化硅与烧碱溶液反应:SiO2
+2OH- === SiO32-+H2O↑
D.硅酸与烧碱溶液中和:H2SiO3 +2OH- === SiO32-+2H2O
9.SO2和Cl2都具有漂白性,若将等物质的量的这两种气体同时作用于潮湿的有色物质,可观察到有色物质D
A.立刻褪色 B.慢慢褪色 C.先褪色,后复原 D.颜色不褪
10.下列关于SO2的叙述,正确的是A
A.SO2既可以是含硫物质的氧化产物,又可以是含硫物质的还原产物
B.SO2是硫酸的酸酐
C.大气中SO2的主要来源是汽车排出的尾气
D.SO2具有漂白性,因而可以使石蕊试液褪色
 二.填空题(14分)
二.填空题(14分)
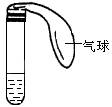
11.(10分)某学生课外活动小组利用右图所示装置分别做如下实验:
(1)在试管中注入某红色溶液,加热试管,溶液颜色逐渐变浅,冷却后恢复红色,则原溶液可能是________________溶液;加热时溶液由红色逐渐变浅的原因是:________________________________________。
(2)在试管中注入某无色溶液,加热试管,溶液变为红色,冷却后恢复无色,
则此溶液可能是________________溶液;加热时溶液由无色变为红色的原因是:_____________________________________________________________。
12.甲、乙两相邻的化工厂,排放的污水经处理后,仍然各溶有以下八种离子(Ag+、Fe3+、Ba2+、Na+、Cl-、SO42-、NO3-、OH-)中各不相同的 4种,若单独排放,则造成环境污染,如果将甲、乙两厂的污水按适当比例充分混合,再经沉淀后,排放的污水转变为无色澄清的NaNO3溶液,污染程度大为降低,又经测定,甲厂污水的pH大于7,试推断:
(l)甲厂污水中含有的4种离子是 ;
(2)乙厂污水中含有的4种离子是 .
13. 硫酸的性质有:A.高沸点;B.强酸性;C.吸水性;D.脱水性;E.强氧化性。在下列硫酸的用途或化学反应中,硫酸可能表现上述的一个或者多个性质,试用字母填空:
(1)实验室制取氢气________________;
(2)实验室干燥氢气___________________;
(3)浓硫酸与金属铜的反应________________;
(4)实际生产中,浓硫酸可用钢瓶贮运_________;
(5)浓硫酸使蔗糖变黑,且有刺激性气味的气体产生_______________。
三.实验题(20分)
14.(1)浓硫酸与木炭粉在加热条件下的化学方程式为_________________________。
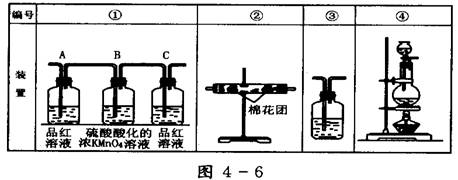
(2)已知酸性KMnO4溶液可以吸收SO2,试用图4-6所示各装置设计一个实验,验证上述反应所产生的各种产物。
这些装置的连接顺序(按产物气流从左到右的方向)是(填装置的编号):
__________→__________→__________→__________。
(3)实验时可观察到装置①中A瓶的溶液褪色,C瓶的溶液不褪色。A瓶溶液的作用是______________________,B瓶溶液的作用是____________________,C瓶溶液的作用是_________________________。
(4)装置②中所加的固体药品是_______________,可确证的产物是_______,确定装置②在整套装置中位置的理由是_____________________。
(5)装置③中所盛溶液是__________,可验证的产物是__________。
四.计算题(16分)
15.将32.64g铜与140mL一定浓度的硝酸反应,铜完全溶解产生的NO和NO2混合气体在标准状况下的体积为11.2L。
(1)NO的体积为多少?
(2)NO2的体积为多少?
江海中学高一化学第四章《非金属及其化合物》单元测试题
参考答案
一、1 A、2C、3A、4A、5 B、6B、7D、8 CD、9D、10A
二、11、(1)稀氨水和酚酞 ;稀氨水中的NH3气逸出,所以溶液的颜色变浅
(2)溶有SO2的品红 ;SO2气体逸出,品红溶液恢复红色
12、(l)甲厂污水中含有的4种离子是 Na+、Cl-、SO42-、OH-;
(2)乙厂污水中含有的4种离子是 Ag+、Fe3+、Ba2+、NO3-.
13. (1) B ;(2) C ;(3) BE; (4) E; (5) DE (提示:浓硫酸使蔗糖脱水炭化的同时,生成的单质碳在该环境下,与浓硫酸继续发生氧化还原反应,生成具有刺激性气味的SO2气体)
三、14.(1)C+2H2SO4(浓)![]() 2SO2↑十CO2↑十2H2O↑
2SO2↑十CO2↑十2H2O↑
(2)④→②→①→③
(3)验证产物气流中是否有SO2将SO2全部氧化吸收确证产物中SO2已被B瓶溶液全部氧化
(4)无水CuSO4(或变色硅胶)水蒸气由于产物气流通过①、③时会带出水蒸气,所以②必须在①、③之前
(5)澄清石灰水CO2
解析:木炭与浓硫酸加热反应,生成CO2和SO2。CO2和SO2都跟澄清石灰水中的Ca(OH)2反应,生成CaSO3和CaCO3使澄清石灰水变浑浊,这相互干扰鉴别。在SO2、CO2混合气体中,首先用品红可检查SO2存在,然后将SO2氧化去除,再用澄清石灰水检验CO2的存在。
点评:品红是鉴别SO2的试剂,CO2不与品红作用。CO2和SO2在化学性质上有许多相似处:都是酸性氧化物;都能溶于水得酸;都与Ca(OH)2反应生成沉淀,通入过量的CO2或SO2时,生成的CaCO3、CaSO3沉淀溶解,变成Ca(HCO3)2、Ca(HSO3)2,溶液重新变澄清。CO2中“C”为高价,SO2中“S”为中间价,都可被还原为低价,因此,CO2、SO2有氧化性。
四、15.解:设混合物气体中NO的物质的量为a,NO2的物质的量为b。
(1)4HNO3(浓)+Cu=Cu(NO3)2+2NO2↑+2H2O
随着反应的进行,硝酸的浓度逐渐减小,进行下列的反应
(2)8HNO3(稀)+3Cu=3Cu(NO3)2+2NO↑+4H2O
由两个反应方程式中NO2与Cu,NO与Cu的计量关系,及已知数据可列方程组:
a+b=11.2L/22.4L·mol-1….…………………①
3a/2+b/2=32.64g/64g·mol-1….…………….②
解①②两个方程,得:a=0.26mol
b=0.24mol
所以NO的体积为:0.26mol×22.4 L·mol-1=5.8L
NO2的体积为:0.24mol×22.4 L·mol-1=5.4L