单元测验
第二章 碱金属
班 学号 姓名 得分
相对原子质量 H 1 Li 9 C 12 O 16 Na 23 Al 27
Fe 56 Zn 65
注意:请将选择题答案填在选择题后的选择题答案栏中!!
一、选择题(共15小题,每小题3分,共45分。每小题只有一个选项符合题意。)
1.常温常压下,下列物质在空气里不发生变化的是 ( )
A. Na2CO3·10H2O B. NaHCO3 C. Na D. NaOH
2.CO2跟下列物质反应能产生O2的是 ( )
A. NaOH B. Na2O C. Na2O2 D. Na2CO3
3.下列各组物质在一定条件下反应,不产生氧气的是 ( )
A. Na2O2和H2O B. Na2O和H2O C. KClO3和MnO2 D . Na2O2和CO2
4.下列混合物溶于水,所得溶液中溶质只有一种的是 ( )
A. Na2O2和Na2CO3 B. Na和NaCl C. Na2O和Na2O2 D. NaOH和K
5.把一小块碱金属投入水中,能与水反应,但不会熔化为小球状的是 ( )
A. 钠 B. 钾 C. 锂 D. 铯
6.质量为1 g的下列金属,分别与足量的盐酸反应,放出H2最多的是 ( )
A. Zn B. Fe C. Al D. Na
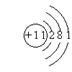
7.除去混在碳酸钠粉末里的碳酸氢钠,最好的方法是 ( )
A. 加热 B. 加盐酸
C. 加石灰水 D. 加氯化钡溶液
8.少量金属钠在空气中长期放置,最终生成的物质是 ( )
A. Na2O B. Na2O2 C. NaOH D. Na2CO3
9.关于氧化钠和过氧化钠的性质比较中,正确的是 ( )
A. 两者均为白色固体
B. 过氧化钠比氧化钠稳定
C. 过氧化钠可与水及二氧化碳反应,而氧化钠则不能
D. 两者都具有漂白性
10.相同质量的碳酸钠和碳酸氢钠,与足量盐酸反应后放出的CO2的量 ( )
A. 一样多 B. 前者比后者多
C. 后者比前者多 D. 无法确定
11.在下列反应中,水作还原剂的是 ( )
A. 2Na+2H2O=2NaOH+H2 B. 2Na2O2+2H2O=4NaOH+O2
C. 2F2+2H2O=4HF+O2 D. CaO+H2O=Ca(OH)2
12.下列物质间发生反应的离子方程式,书写错误的是 ( )
A. 锌与稀硫酸 Zn+2H+=Zn2++H2
B. 大理石与稀硝酸 CaCO3+2H+=Ca2++CO2+H2O
C. 钠跟水反应:Na+2H2O = Na++2OH-+H+↑
D. 氢氧化钾溶液与氯化镁溶液混合 2OH-+Mg2+=Mg(OH)2¯
13.过氧化钠与足量NaHCO3的混合后,在密闭容器中充分加热,排除气体物质后冷却,残留的是 ( )
A. Na2CO3和Na2O2 B. Na2CO3和NaOH
C. Na2CO3 D. Na2O、Na2O2和Na2CO3
14.下列金属燃烧火焰的焰色为紫色的是 ( )
A. Na B. Ca C. K D. Cu
15.下列各组离子在溶液里不能大量共存的是 ( )
A.
Na+、Mg2+、Cl-、![]() B. K+、H+、
B. K+、H+、![]() 、
、![]()
C.
![]() 、K+、Br-、
、K+、Br-、![]() D. Ba2+、Na+、OH-、
D. Ba2+、Na+、OH-、![]()
选择题答案栏:
| 题号 | 1 | 2 | 3 | 4 | 5 | 6 | 7 | 8 |
| 答案 | ||||||||
| 题号 | 9 | 10 | 11 | 12 | 13 | 14 | 15 | |
| 答案 |
二、填空题(34分)
16.(6分)简答:
(1) 观察钾的焰色反应时,使用蓝色钴玻璃片的作用是
。
(2) 为什么NaOH固体要密闭保存?
17.(6分)单质钠在空气中燃烧时火焰的颜色为_______色,产物为_______ 色固体,它可以作为潜水艇里______________的来源。
18.(8分)在防毒面具里,常用过氧化钠作为氧气的主要来源,是因为它能和二氧化碳、水等物质发生反应,试写出反应的化学方程式。
_____________________________________________________,
_______________________________________________________。
19.(6分)在碱金属锂、钠、钾、铷、铯中,原子半径最小的是 ,略带金色光泽的是 ,金属钠的密度比金属钾的密度 ,原子中含有4个电子层的是 ,钠的原子结构示意图是 ,这五种碱金属的还原性由强到弱的顺序是 。
20.(8分)有4种钠的化合物W、X、Y、Z,根据以下反应式判断W、X、Y、Z的化学式。
W ![]() X+CO2↑+H2O
Z+H2O
─→Y+O2↑
X+CO2↑+H2O
Z+H2O
─→Y+O2↑
Y+CO2 ─→ X+H2O Y+CO2 ─→ W
W___________,X___________,Y__________,Z__________。
三、(11分)
21.(4分)写出下列反应的离子方程式:
(1) 氢氧化钾反应与硫酸铜溶液反应
(2) 碳酸钠溶液与氢氧化钙溶液反应
22.(7分)标电子转移的方向和总数,指出氧化剂和还原剂。
2Na+CuSO4+2H2O=Na2SO4+Cu(OH)2¯+H2↑
氧化剂是 ,还原剂是 。
四、计算题(10分)
23.取NaHCO3和Na2CO3混合粉末5.26 g,将其加热至质量不再改变,残余固体质量为3.71 g。求该混合物中NaHCO3和Na2CO3的质量。
答 案
1.B 2.C 3.B 4.C 5.C 6.C 7.A 8.D 9.B 10.C 11.C 12.C 13.C 14.C 15.B
16. (1) (3分)滤去黄色的光,避免钠所造成的干扰
(2) (3分)因为NaOH能与空气中的水蒸气和二氧化碳反应。
17. (每空2分)黄; 淡黄; 氧气
 18. (每空1分)2Na2O2+2CO2=2Na2CO3+O2;2Na2O2+2H2O = 4NaOH+O2
18. (每空1分)2Na2O2+2CO2=2Na2CO3+O2;2Na2O2+2H2O = 4NaOH+O2
19. (每空1分)锂;铯;大;钾; ;铯、铷、钾、钠、锂
20. (每空2分)NaHCO3; Na2CO3; NaOH; Na2O2
21. (每空2分)(1) 2OH-+Cu2+=Cu(OH)2¯;(2) ![]() +Ca2+=CaCO3¯
+Ca2+=CaCO3¯
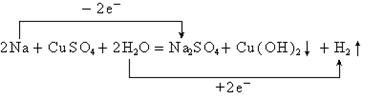 22.
22.
H2O;Na(标3分,氧化剂和还原剂各2分)
23. 设NaHCO3的质量为x,
2NaHCO3![]() Na2CO3+CO2+H2O
Dm
(2分)
Na2CO3+CO2+H2O
Dm
(2分)
84×2 18 44 62
x 5.26 g-3.71 g=1.55 g (2分)
m(NaHCO3)=x=![]() ×1.55 g=4.2 g,(3分)
×1.55 g=4.2 g,(3分)
m(Na2CO3)=5.26 g-4.2 g=1.06 g。(3分)