吉林省实验中学2003—2004学年上学期学科期末试卷
高 一 化 学
可能用到的相对原子质量:H:1 C:12 N:14 O:16 F:19 Na:23 S:32
Cl:35.5 K:39 Ca:40 Fe:56 Cu:64 Br:80 Ag:108 I:127 Ba:137
一、选择题(每题只有一个选项正确,每题2分,共10分)
1.由N2、NO、CO2组成的混合气体中,三种成分的体积分数之比为1:2:1,则三种成分的质量比为 ( )
A.1:2:1 B.14:15:22
C.7:15:11 D.1:1:1
2.某硫酸溶液物质的量浓度是xmol/L,含硫酸的质量分数为a%,则该溶液的密度是( )
A.![]() B.
B.![]()
C.![]() D.
D.![]()
3.溴化碘(IBr)的化学性质与卤素单质相似,能与大多数金属反应生成金属卤化物,能与许多非金属单质反应生成相应卤化物,能与水反应等。其与水反应的方程式为IBr+H2O=HBr+HIO下列关于IBr的叙述中不正确的是 ( )
A.IBr是一种有色物质
B.在许多反应中IBr是强氧化剂
C.在IBr与水的反应中,它既是氧化剂又是还原剂
D.与NaOH溶液反应生成NaIO NaBr
4.实验室制备HCl,在反应前有下面的操作:①烧瓶里盛食盐,分液漏斗盛入浓硫酸②把酒精灯放在铁架台上③将烧瓶夹上④夹放好铁圈和石棉网⑤将带分液漏斗和导管的橡皮塞塞到烧瓶口⑥检查仪器装置的气密性。正确的顺序是 ( )
A.①⑥②③④⑤ B.①⑤⑥②③④
C.⑥②③④①⑤ D.②④③⑤⑥①⑤
5.下列说法没有科学性错误的是 ( )
A.“白雪牌”漂粉精可令所有物质黯然失色,没有最白,只有更白。
B.液态氯化氢是100%的盐酸,其H+浓度极大。
C.氯化钙具有吸水性和潮解性,夏日里用它的水溶液喷洒柏油路,可有效保护路面
D.氯元素有毒,禁入口中。
二、选择题(每题有一个正确选项,每题3分,共45分)
6.下列各组物质的性质比较中,正确的是 ( )
A.碳酸钠、碳酸氢钠、碳酸的热稳定性依次递减
B.铷、钾、钠、锂、氢气的熔点依次降低
C.碳酸、碳酸氢钠、碳酸钠的溶解度依次降低
D.Rb+、K+、Na+、Li+、H+的氧化性依次减弱
7.以下反应的离子方程式正确的是 ( )
A.氢氧化铁与盐酸反应H++OH-=H2O
B.石灰水通入过量的CO2 2OH-+Ca2++CO2=CaCO3↓+H2O
C.碳酸氢钠溶液与氢氧化钡溶液反应H++CO32-+Ba2++OH-=BaCO3↓+H2O
D.三氧化硫与氢氧化钠溶液反应SO3+2OH-=SO42-+H2O
8.从海水中提取溴有如下反应:5NaBr+NaBrO3+3H2SO4=3Br2+Na2SO4+3H2O,与此反应在氧化还原原理上最相似的是 ( )
A.2NaBr+Cl2=2NaCl+Br2
B.AlCl3+3NaAlO2+6H2O=4Al(OH)3↓+3NaCl
C.2H2S+SO2=2H2O+3S
D.2FeCl3+H2S=2FeCl2+S↓+2HCl
9.某种H2和CO的混合气体,其密度是相同条件下氧气密度的1/2。将3.2g这种混合气体充入一盛有足量Na2O2的密闭容器中,在通入过量的O2,并用电火花点燃使其充分反应,最后容器中固体质量增加了 ( )
A.3.2g B.4.4g
C.5.6g D.6.4g
10.某种混合气体,可能含有N2、HCl、CO,把混合气体依次通过足量的 NaHCO3溶液和灼热的CuO,气体体积都没有变化,在通过足量的Na2O2固体,气体体积减小。最后通过灼热的铜网,经充分反应后气体体积又减少,但还有剩余气体,以下对混合气体组分的判断正确的是 ( )
A.一定没有N2;CO和HCl中至少有一种
B.一定有N2、HCl和CO
C.一定有N2;CO和HCl中至少有一种
D.一定有N2和HCl没有CO
11.某金属氧化物的相对分子质量为A,相同价态金属硫酸盐的相对分子质量为B,则该金属化合价应表示为 ( )
A.(A—B)/20 B.(B—A)/20
C.(B—A)/30 D.(B—A)/80
12.在Vml硫酸铁的溶液中,含Fe3+的质量为Ag,取0.5Vml溶液加水稀释到2Vml,溶液中SO42-物质的量浓度为 ( )
A.3A/112V mOL/l B.375A/14V mol/L
C.375A/56V mol/L D.75A/56V mol/L
|
A.浓H2SO4
B.CaCl2溶液
C.H2O
D.饱和NaCl溶液
14.将过量Cl2通入到250mLNaI溶液中,充分反应后,用小火把溶液蒸干,冷却后得到固体12g,其中25%的碘,则原NaI溶液的物质的量浓度是 ( )
A.0.62mol/L B.0.09mol/L
C.0.047mol/L D.0.1mol/L
15.碱金属元素随核电荷数的增加,下列变化中与卤素变化一般趋势不一致的是 ( )
A.单质的熔、沸点 B.单质的密度
C.原子的电子层数 D.原子半径
16.被称为万能还原剂的NaBH4溶于水并和水反应:NaBH4+2H2O=NaBO2+4H2↑
下列说法中正确的是(NaBH4中H元素为-1价) ( )
A.NaBH4既是氧化剂又是还原剂
B.NaBH4是还原剂,H2O是氧化剂
C.硼元素被氧化,氢元素被还原
D.被氧化的元素与被还原的元素质量比为2:1
|
A.2NaSCN+MnO2+2H2SO4(浓) Na2SO4+(SCN)2↑+MnSO4+2H2O
B.(CN)2+2KI=2KCN+I2
|
D.2AgCN 2Ag+(CN)2
18.取相同体积的KI、Na2S、FeBr2溶液,分别通入足量的Cl2,当反应恰好完成时,消耗Cl2的体积相同(同温、同压条件下),则KI、Na2S、FeBr2溶液的物质的量浓度之比是(注:Na2S+Cl—NaCl+S↓)
A.1:1:2 B.2:1:3
C.6:3:2 D.3:2:1
19.某学生配制100mL 1mol/L的硫酸溶液,进行下列操作,然后对溶液浓度作精确测定,发现真实浓度小于1mol/L。他的下列操作中使浓度偏低的原因是 ( )
|
A.②③④ B.③④
C.①②③ D.①②③④
20.已知反应10AgF+5Cl2+5H2O=9AgCl+AgClO3+10HF+O2,则被1mol水还原的Cl2的物质的量是 ( )
A.0.2mol B.0.4mol
C.0.8mol D.1.0mol
三、填空题(21题2分,22题10分,23题5分,共17分)
21.已知硫酸溶液的浓度越大,密度也越大,40%的硫酸和50%的硫酸等质量混合后,所得溶液的质量分数 (大于、小于、等于)45%;若等体积混合,所得溶液的质量分数 (大于、小于、等于)45%。
22.完成下列离子方程式
①CO2+( )+(
) CaCO3↓+H2O
②HCO3—+( ) CO32—+( )
|
④MnO2+4HCl(浓) MnCl2+2H2O+Cl2↑
⑤MgCO3+H2SO4=MgSO4+H2O+CO2↑
23.有一细小白色晶体状固体A,分为等质量的甲、乙两份,甲份加热发生分解,得到残留物C,同时产生能使石灰水变混浊的气体B;乙份加足量盐酸,也产生气体B,但产生气体的量是甲份的两倍,气体B跟淡黄色固体粉末D反应,产生无色无味气体E,同时又得到C,领另取少量粉末A,进行焰色反应,火焰显黄色,写出A—E的化学式;
A B C D E
四、实验题(24题12分,25题6分,共18分)
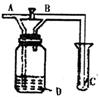
24.(1)写出洗涤下列仪器所用试剂的名称(或化学式)
①做过碘升华试验的烧杯 ②做过高锰酸钾分解反应的试管
③久置石灰水的试剂瓶
(2)除去括号中杂质,写出所加试剂的化学式或使用方法:
①NaCl(I2) ②NaCl溶液(NaBr) ③Cl2(HCl)
|
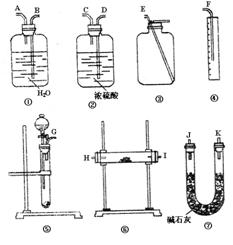
选择适当的实验装置,设计一个最简单的实验,
测定Na2O2试样的纯度(可供选用的反应物只
有碳酸钙固本,一定浓度的盐酸和蒸馏水)。
请填写下列空白:
①写出在实验中Na2O2和Na2O分别
发生反应的化学方程式 ,
。
②应选用的装置(只要求写出图中装置
的标号) 。
③所选用装置的连接顺序应是(填各接
口的字母,连接胶管省略) 。
五、计算题(26题4分,27题6分,共10分)
26.某盐酸的密度为1.1g/cm3,HCl的质量分数为10%。求:
①该盐酸的物质的量浓度为多少?
②200mL该盐酸与过量的铁屑充分反应,生成H2的体积(标准状况)是多少?生成FeCl2
的物质的量浓度是多少?(溶液体积变化可忽略)
27.在标准状况下,将质量为相同状况下同体积甲烷(CH4)质量2倍的二氧化碳、一氧化碳的混合气体,充满盛有足量过氧化钠,且容积为22.4升的密闭容器中(假设固体的体积忽略不计),用间断发生的电火花引发,使可能发生的反应都充分进行。试求:
①反应前充入容器中二氧化碳和一氧化碳的物质的量各多少?
②最后容器中的生成物是什么,其质量各为多少?
吉林省实验中学2003—2004学年上学期学科期末试卷
高一化学参考答案
一、选择题
| 1 | 2 | 3 | 4 | 5 |
| C | D | C | D | C |
二、选择题
| 6 | 7 | 8 | 9 | 10 | 11 | 12 | 13 |
| A | D | C | A | C | D | C | A |
| 14 | 15 | 16 | 17 | 18 | 19 | 20 | |
| A | A | B | C | C | D | D |
三、填空题
21.等于、大于
22.①Ca2+、2OH- ②OH-、H2O ③H+、H2O ④MnO2+4H++2Cl-=Mn2++2H2O+Cl2↑
⑤MgCO3+2H+=Mg2++H2O+CO2↑
23.NaHO3、CO2、Na2CO3、Na2O2、O2
四、实验题
24.(1)①酒精②热的浓盐酸③稀盐酸
(2)①加热②通Cl2后加CCl4,萃取③将Cl2通过饱和食盐水
25.(1)2Na2O2+2H2O=4NaOH+O2↑ Na2O+H2O=2NaOH
(2)①④⑤ (3)GABF
五、计算题
26.①3mol/L ②6.72L、1.5mol/L
27.①CO2 0.25mol,CO 0.75mol ②Na2CO3 106g, O2 4g