南宁市26中2005-2006学年度高一下学期期中考试
化学试卷
命题:莫振华
说明:
本试卷分为第Ⅰ卷(选择题)、第Ⅱ卷(非选择题)和答卷卡两部分,试卷1至5页,答卷卡6至7页,共150分。考试时间120分钟。
第Ⅰ卷(选择题 共77分)
注意事项:
1.答第Ⅰ卷前考生务必在答卷卡填上自己的班级、姓名。
2.每小题选出答案后,将答案选项填入答卷卡选择题答案栏上,答在其它位置无效。
3.考试结束,监考人员只须将答卷卡收回。
可能用到的原子量: H-1 C-12 N-14 O-16 Na-23 S-32 Cl-35.5 Cu-64 Zn-65 Ba-137 Ca-40 P-31
一、 选择题(本题包括11小题,每小题3分,共33分。每小题只有一个选项符合题意。)
1.提出元素周期律并绘制了第一个元素周期表的科学家是( )
A.戴维 B.阿伏加德罗 C.门捷列夫 D.道尔顿
2.下列物质中,不属于同素异形体的是 ( )
A.O2和O3
B.白磷和红磷 C.![]() D.石墨和金刚石
D.石墨和金刚石
3.下列化合物中,阳离子半径与阴离子半径比值最小的是 ( )
|
4.右图为周期表的一部分,已知A、B、C、D、E五种元素的原子核外
共有电子85个,E原子核外有4个电子层,则B元素为( )
A. Si B.P C.S D.Cl
5.下列化合物中,既有离子键,又有共价键的是 ( )
A.H2SO4 B.KOH C.SO3 D.CaCl2
6.Na和Na+两种粒子中,相同的是 ( )
①核电荷数 ②核外电子层数 ③最外层电子数 ④核内质子数
A.①② B.③④ C.①②④ D.①④
7.下列物质具有杀菌消毒作用,其中杀菌能力强又不会影响水质的是 ( )
A.液氯 B.漂粉精 C.臭氧 D.熟石灰
8.下列事实不能用来判断金属性强弱的是( )
A.金属间发生置换反应 B.1mol金属单质在反应中失去的电子数
C.金属元素的最高价氧化物的水化物的碱性强弱
D.金属单质与水或酸反应置换出氢的难易
9.有人提议元素周期表不再按不同的纵行分成主族、副族、零族、VⅢ族,而直接按各元素所在的列编号,如第1列、第2列、第3列……如果按此种编号方法,氧族元素应位于 ( )
A.第4列 B.第11列 C.第14列 D.第16列
10.含硒(Se)的保健品已开始进入市场。已知硒与氧同主族,与钾同周期,则下列关于硒的叙述中,正确的是( )
A.非金属性比硫强 B.氢化物比HBr稳定
C.原子序数为34 D.最高价氧化物的水化物显碱性
11.下列叙述正确的是( )
A. 在离子化合物中一定存在着离子键 B. 在离子化合物中一定存在着共价键
C.全部由非金属构成的化合物一定不存在离子键
D.在共价化合物中一定含有共价键
二、不定项选择题(本题包括11小题,每小题4分,共44分,每小题有一个或二个选项符合题意)
12.电子数相等的粒子叫等电子体。下列粒子属等电子体的是( )
A.CH4和NH4+ B.NO和O2 C.NH2—和H2O2 D.HF和H2O
13.下列关于化学反应的现象或产物描述错误的是 ( )
A.铁粉和硫粉混合加热生成黑色的FeS
B.铜丝在硫蒸气中燃烧生成黑色的CuS
C.铜片在氧气中加热,生成黑色的CuO
D.铁在氧气中燃烧产生黑色的Fe3O4
14.下列离子方程式的书写正确的是 ( )
A.硫酸中加氢氧化钡:SO42-+H++Ba2++OH-=BaSO4↓+H2O
B.B.MnO2与浓HCl反应制Cl2:MnO2+4H++2Cl-=Mn2++Cl2↑+2H2O
C.CO2通入澄清石灰水,出现白色浑浊:CO2+Ca2++2OH-=CaCO3↓+H2O
D.Fe片投入稀H2SO4:2Fe+6H+=2Fe3++3H2↑
15.某元素R的气态氢化物为H2R,则它的氧化物对应的水化物的化学式可能为( )
A.H2RO3 B.HRO4 C.H2RO4 D.H3RO4
16.已知mRn—阴离子的原子核内有x个中子,则ω克mRn—阴离子中含有的电子的物质的量为( )
A.![]() B.
B.![]() C.
C.![]() D.
D.![]()
17.已知X+、Y2+、Z-、W2-四种离子均具有相同的电子层结构。下列关于X、Y、Z、W四种元素的描述,不正确的是( )
A.原子半径:X>Y>Z>W B.原子序数:Y>X>Z>W
C.原子最外层电子数:Y>X>Z>W D.金属性:X>Y,还原性:W2->Z-
18.和氖原子具有同的电子层结构的微粒是( )
![]()
![]() A、Na+ B、 C、
D、S2-
A、Na+ B、 C、
D、S2-
19.科学家最近制造出第112号新元素,其原子的质量数为277,这是迄今已知元素中最高的原子。关于该新元素的下列叙述正确的是( )
A.其原子核内中子数和质子数都是112
B.其原子核内中子数为165,核外电子数为112
C.其原子质量是12C原子质量的277倍
D.其原子质量与12C原子质量之比为277∶12
20.某元素的最高正价与负价的绝对值之差等于2,其气态氢化物中含氢8.82%,此元素可能是( )
A.P B.S C.N D.O
21.在bXm-和aYn+两种微粒,它们的电子层结构相同,则a,m,n,b的关系是( )
A. a=b-m-n B. b+m+n=a C. a=b-m+n D. m-n+b=a
22.实际存在的![]() H、
H、![]() H、
H、![]() H、H+和H,它们是 ( )
H、H+和H,它们是 ( )
A. 氢的五种同位素 B. 五种氢元素
C. 氢元素的五种不同微粒 D. 氢的五种同素异形体
第Ⅱ卷(非选择题 共73分)
三、填空题:(共30分)
23.(6分)用化学用语回答下列问题。
⑴画出S2-的原子结构示意图: _。
⑵画出NaOH的电子式: _。
⑶写出双氧水中加少量MnO2的化学反应方程式:_ 。
24.(7分)将下列环境问题所对应的主要原因(A-G)填在相应的空格中(每格中只填一个字母)。
环境问题 产生原因
⑴酸雨_ _ A.空气中CO2浓度不断上升
⑵水土流失_ _ B.大量使用塑料包装袋和塑料农用地膜
⑶臭氧层被破坏_ _ C.工业上大量排放SO2
⑷温室效应_ _ D.大量使用农药和化肥
⑸白色污染_ _ E.生活污水大量排放,使藻类大量繁殖,水体严重缺氧
⑹土壤污染 _ _ F.乱砍滥伐森林
⑺水体“富营养化” G.大量使用氟利昂制品
25.(9分)在1~18号元素中(稀有气体元素除外)
(1)原子半径最小的元素是________;(2) 地壳中含量最高的非金属元素是 ;
(3)非金属性最强的元素是________; (4)金属性最强的元素是________;
(5)最高价氧化物对应水化物中碱性最强的是________,它对应的氧化物的化学式为________;(6)最高价氧化物对应水化物中酸性最强的是________,它对应的氧化物的化学式为 ;(7) 常温下有色的气体单质是 。
26.(8分)用A.质子数 B.中子数 C.核外电子数 D.最外层电子数 E.电子层数 填写下列空白:
⑴同位素种类由 决定; ⑵元素种类由 决定;
⑶核电荷数由 决定; ⑷同位素相对原子质量由 决定;
⑸元素的原子半径由 决定; ⑹元素的化合价主要由 决定;
⑺元素的化学性质主要由 决定; ⑻价电子数通常是指 ;
四、推断题(共22分)
27.(8分)A、B、C为短周期元素,在周期表中如右图所示:A、C两种元素的原子核外电子数之和等于B原子的核电荷数。
| A | C | |
| B |
(1)A 原子的原子结构示意图为 。
其最高价氧化物的分子式为: 。
(2)B离子的电子式为: 。
(3)用电子式表示C单质分子的形成过程: 。
28.(14 分)A、B、C、D四种元素,A单质在B单质中燃烧发出苍白色火焰,C单质跟A、D形成的化合物的水溶液反应生成A单质,C原子与B原子的电子层相同,且最外层电子数之差为奇数,D原子最外层电子数为K层电子数的3倍,其单质为淡黄色固体。
(1)四种元素符号为A ,B ,C ,D ;
(2)离子的电子层结构相同的二种元素是 ,离子的结构示意图分别为 、 ;
(3)四种元素中能形成AB型共价化合物的元素是 ,由它们的同位素原子形成的AB型分子共有 ,其中质量数最小的一种分子可用同位 素符号表示为 ;
(4)A、B、C、D原子形成的最高价氧化物的分子式分别为 、 、 、 .
五、实验题:(4分,方程式2分,其余每空1分)
 29.如图所示,在一烧杯中盛有H2SO4溶液,
29.如图所示,在一烧杯中盛有H2SO4溶液,![]() 同时有一表面光滑的塑料小球悬浮于溶液中央,向该烧杯中缓缓注入 Ba(OH)2溶液至恰好完全反应[设H2SO4和Ba(OH)2溶液密度相同]。
同时有一表面光滑的塑料小球悬浮于溶液中央,向该烧杯中缓缓注入 Ba(OH)2溶液至恰好完全反应[设H2SO4和Ba(OH)2溶液密度相同]。
试回答
![]()
⑴此实验中,观察到的现象有
① ,
② 。
⑵写出实验过程中反应的离子方程式为 。
六、计算题:(17分)
30.(10分)3.2克某元素A的单质与氢气化合生成3.4克气态氢化物H2A。已知A的原子核中质子数与中子数相等,则A的相对原子量为 ,原子序数是 ,
元素符号为 ,元素A位于第 周期 族,它的最高价氧化物的化学式是 ,气态氢化物的化学式是 。
30.(7分)已知氯元素的相对原子质量为35.5,由![]() 、
、![]() 和
和![]() 构成的10g氯化钠中,已知
构成的10g氯化钠中,已知![]() 和
和![]() 的组成与天然存的组成相同,求其中所含
的组成与天然存的组成相同,求其中所含![]() 和
和![]() 两种原子的质量分别是多少g?
两种原子的质量分别是多少g?

2005—2006学年高一下学期期中考化学试卷
答题卡
注意事项:
1.答卷前考生务必填上自己的班级、姓名。
2.请将选择题答案填写在第6页答案表内,考试结束后只交第6、7页答卷卡;1至5页试卷请妥善保存。
3.请用碳素笔或圆株笔作答。
化学科答题卷
| 题号 | 一 | 二 | 三 | 四 | 五 | 六 | 总分 |
| 得分 |
|
|
|
|
|
|
|
第一卷 选择题答案表(共77分)
| 题号 | 1 | 2 | 3 | 4 | 5 | 6 | 7 | 8 | 9 | 10 | 11 |
| 答案 | |||||||||||
| 题号 | 12 | 13 | 14 | 15 | 16 | 17 | 18 | 19 | 20 | 21 | 22 |
| 答案 |
第二卷 非选择题(共73分)
三.填空题(本题包括4小题,共30分)
23.(6分)(1)
(2)
(3)
24. (1) (2) (3) (4)
(5) (6) (7)
25.(1) (2) (3) (4) (5) 、
(6) 、 (7)
26.(1) (2) (3) (4) (5)
(6) (7) (8)
四.推断题(本题包括2小题,共22 分)
27.(1) 、 。
(2)
(3)
28.(1)四种元素符号为A ,B ,C ,D ;
(2)离子的电子层结构相同的二种元素是 ,离子的结构示意图分别为 、 ;
(3)四种元素中能形成AB型共价化合物的元素是 ,由它们的同位素原子形成的AB型分子共有 ,其中质量数最小的一种分子可用同位 素符号表示为 ;
(4) 、 、 、 .
五.实验题(本题包括1小题,共4分)
29.(1)① ,
② 。
(2) 。
六.计算题(本题包括2小题,共17分)
30.解:
答:A的相对原子量为 ,原子序数是 ,
元素符号为 ,元素A位于第 周期 族,它的最高价氧化物的化学式是 ,气态氢化物的化学式是 。
31.解:
2005—2006学年高一下学期期中考化学试卷
参考答案及评分标准
第一卷 一、二选择题答案表(共77分)
| 题号 | 1 | 2 | 3 | 4 | 5 | 6 | 7 | 8 | 9 | 10 | 11 |
| 答案 | C | C | C | B | B | D | C | B | D | C | A |
| 题号 | 12 | 13 | 14 | 15 | 16 | 17 | 18 | 19 | 20 | 21 | 22 |
| 答案 | AD | B | BC | AC | C | AC | AC | BD | A | B | C |
第Ⅱ卷(非选择题 共73分)
三、填空题:(36分)
23、(6分,每小题2分)
(1)
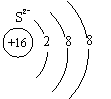
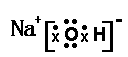 |
(2) -
(3)
![]()
24、(1)C(2)F(3)G(4)A(5)B(6)D(7)E
25、(1)H(2)O(3)F(4)Na(5)NaOH、Na2O(6)HClO4、、Cl2O7、(7)F2或Cl2
26、(1)AB(2)A(3)A(4)AB(5)E(6)D(7)D(8)D
四.推断题(本题包括2小题,共18 分)
27、
 .
.
,N2O5, , + → F F
28、(1)H,Cl,Mg,S (2)BD;略
(3)H、Cl,6种,H![]() Cl (4)H2O,HClO4,Mg(OH)2,H2SO4
Cl (4)H2O,HClO4,Mg(OH)2,H2SO4
五.实验题(本题包括1小题,共22分)
29、(1)溶液里有白色沉淀产生;(2)小球下沉到烧杯底;
(3)Ba2++2OH-+2H++SO42- =BaSO4↓+4H2O;
六.计算题(本题包括2小题,共21分)
30、32;16;S;三、VIA;SO3;H2S
31、答案:4.4625g,1.5725g