拦江中学高一化学第二学期期中考试试题
第I卷(选择题 60分)
可能用到的相对原子质量:H
1 C 12 N14
Na 23 Mg 24 Al 27 S 32 Cl 35.5 Cu64
一.选择题(每小题3分,共60分。每小题只有一个选项符合题意。)
1.据报载我国最近合成多种元素的新的同位素,其中一种是18572Hf(铪),它的中子数是( )
A.72 B.113 C.185 D.257
2. 造成大气污染的SO2,主要来自于 ( )
A.火山爆发 B.硫酸厂排出的尾气
C.煤、石油等化石燃料的燃烧 D.汽车尾气
3. 元素性质呈周期性变化的决定因素是( )
A.元素原子半径大小呈周期性变化 B.元素原子量依次递增
C.元素原子最外层电子排布呈周期性变化 D.元素的最高正化合价呈周期性变化
4. 下列关于化学反应的现象或产物描述错误的是 ( )
A.铁粉和硫粉混合加热生成黑色的FeS
B.铜丝在硫蒸气中燃烧生成黑色的CuS
C.铜片在氧气中加热,生成黑色的CuO
D.铁在氧气中燃烧产生黑色的Fe3O4
5. 1993年8月国际原子量委员会确认我国张青莲教授测定的锑原子量(127.760)为标准原子量,已知锑有两种以上天然同位素,则127.760是( )
A.按照锑的各种天然同位素的质量数与这些同位素所占的原子百分比计算出来的平均值
B.按照锑的各种天然同位素的原子量与这些同位素所占的原子百分比计算出来的平均值
C.一个锑原子的质量与12C原子质量的1/12的比值
D.锑元素的质量与12C原子质量的1/12的比值
6. 下列离子方程式的书写正确的是( )
A.硫酸中加氢氧化钡:SO42-+H++Ba2++OH-=BaSO4↓+H2O
B.MnO2与浓HCl反应制Cl2:MnO2+4H++4Cl-=MnCl2+Cl2↑+2H2O
C.SO2通入澄清石灰水,出现白色浑浊:SO2+Ca2++2OH-=CaSO3↓+H2O
D.Fe片投入稀H2SO4:2Fe+6H+=2Fe3++3H2
7. X是VIA族元素,以下一些该元素组成的粒子的化学式中的n值不一定为2的是
![]() A.阴离子:[ ]n-
B.氧化物:XOn
A.阴离子:[ ]n-
B.氧化物:XOn
C.气态氢化物:HnX D.含氧酸:HnXO4
8.某元素X的最高价氧化物的分子式为X2O5,在它的气态氢化物中含氢3.85%,则该元素 的相对原子质量为( )
A.14 B.31 C.74.9 D.121.8
9. 下面各组离子在溶液中能大量共存的是 ( )
A.Ba2+、K+、HCO3-、CO32- B.Na+、H+、、SO42-、 SiO32-
C.Al3+、Mg2+、Cl-、OH- D.S2-、SO32-、K+、OH-
10.某元素原子的质量数为A,它的阴离子Xn-核外有x个电子,w克这种元素的原子核内中子数为( )
A.![]() B.
B.![]()
C.![]() D.
D.![]()
11. 不能说明氧元素比硫元素非金属性强的事实是 ( )
A.热稳定性H2O比H2S强
B.H2S水溶液在空气中变浑浊
C.H2O比H2S的沸点高
D.在一定条件下,O2与Cu反应生成CuO,S与Cu反应生成Cu2S
12. 下列变化的实质相似的是( )
A、浓硫酸和浓盐酸在空气中敞口放置时浓度均减小
B、SO2和Cl2均使品红溶液褪色
C、浓硫酸和稀硫酸与锌反应时均产生气体
D、HBr、HI气体均不能用浓硫酸制取
13. 科学家根据元素周期律和原子结构理论预测,原子序数为114的元素属于第七周期ⅣA族, 称为类铅元素.下面关于它的原子结构和性质预测不正确的是( )
A.类铅元素原子的最外层电子数为4 B.其常见价态为+2、+4
 C.它的金属性比铅强
D.它的原子半径比铅小
C.它的金属性比铅强
D.它的原子半径比铅小
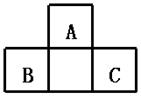
14.A、B、C均为短周期元素,它们在周期表中的位置如右图.已知B、C两元素在周期表中族 序数之和是A元素序数的2倍;B、C元素的原子序数之和是A元素原子序数的4倍,则A、B、C 所在的一组是( )
A.Be、Na、Al B.B、Mg、Si C.O、P、Cl D.C、Al、P
15. 下列属于同素异形体的是:
A.H2O和H2O2 B.12C和14C C.O2和O3 D.T2O和D2O
16.同周期的X、Y、Z三种元素,已知其高价氧化物对应的水化物的酸性强弱顺序是:HXO4>H2YO4>H3ZO4,则下列各判断中正确的是( )
A.原子半径:X>Y>Z B.单质的非金属性:X>Z>Y
C.气态氢化物稳定性:X<Y<Z D.原子序数:X>Y>Z
17.下列各组化合物中,化学键类型完全相同的是 ( )
A.H2O和Na2O B.NaOH和NaCl C.H2O2和Na2O2 D.CCl4和HCl
18.下列各分子中,所有原子都满足最外层为8电子结构的是( )
A.H2O B.BF3 C.CCl4 D.PCl5
19.已知下列氧化剂均能氧化+4价的硫元素,为了除去稀硫酸中的亚硫酸,宜选用的氧化剂是
A.HNO3 B.H2O2 C.Cl2 D.Na2O2
![]() 20.将10L空气通过臭氧发生器,有部分氧气发生反应:3O2 2O3,得到9.7L混合气体,则得到臭氧的体积(同条件)是( )
20.将10L空气通过臭氧发生器,有部分氧气发生反应:3O2 2O3,得到9.7L混合气体,则得到臭氧的体积(同条件)是( )
A.1L B.0.5L C.0.3L D.0.6L
姓名: 班级 学号:
一、选择题(3×20=60分)
| 题号 | 1 | 2 | 3 | 4 | 5 | 6 | 7 | 8 | 9 | 10 |
| 答案 | ||||||||||
| 题号 | 11 | 12 | 13 | 14 | 15 | 16 | 17 | 18 | 19 | 20 |
| 答案 |
第Ⅱ卷(非选择题 4 0分)
二.简答题:(30分)
21.(4分)用化学用语回答下列问题。
⑴写出NaOH的电子式:_ _。
⑵某种硅酸盐的主要成分为Na2CaSi6Ox,其中x= ,
(3)用电子式表示H2S分子的形成过程:
(4)画出S2-的离子结构示意图:_ _。
22.(6分)下图虚线框中的装置可用来检验浓H2SO4与木炭粉在加热条件下反应产生的所有气体产物,填写下列空白:(已知:高锰酸钾溶液呈紫色,有强氧化性能与二氧化硫反应)
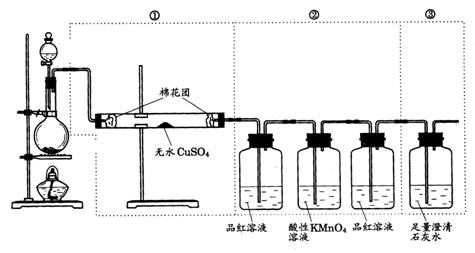
(1)如果将装置中①、②、③三部分仪器的连接顺序变为②、①、③,则可以检出的物质是________;不能检出的物质是_____________.
(2)如果将仪器的连接顺序变为①、③、②,则可以检出的物质是________;不能检出的物质是________.
(3)如果将仪器的连接顺序变为②、③、①,则可以检出的物质是________;不能检出的物质是________.
23. ( 3分) 已知SO2遇H2S气体时表现出氧化性,发生如下反应:SO2+2H2S=3S+2H2O,在标准状况下,向一个容积为1L的容器里加入![]() L的SO2和
L的SO2和![]() L的H2S,则反应结束时容器中的压强是开始的 倍。(水蒸气压忽略不计)
L的H2S,则反应结束时容器中的压强是开始的 倍。(水蒸气压忽略不计)
24.(6分)有X、Y、Z、W四种短周期元素,原子序数依次增大,其核电荷数总和为38,Y元素原子最外层电子数占核外电子总数的![]() ;W元素原子最外层电子比同周期Z元素多5个电子,W和Y不属于同一主族。
;W元素原子最外层电子比同周期Z元素多5个电子,W和Y不属于同一主族。
(1)写出元素符号:X ,Y ,Z ,W ;
(2)Z、W两种元素最高价氧化物对应水化物反应的方程式是
25.(11分,每空1分)
下图是实验室制取SO2并验证SO2某些性质的装置图,试回答:

⑴①中发生反应的化学方程式为;_______________
⑵②中的实验现象为_________,此实验证明SO2是_______ __氧化物;
⑶③中的品红溶液___________,此实验证明SO2有_________ ____性;
⑷④中的现象是_____________,此实验证明SO2有_________ __性;
⑸⑤中的现象是_____________,此实验证明SO2有___________ _ _性;
⑹⑥的作用是_______________,反应式是____________ ____ __
三.计算题(共10分)
26. (4分)用20mL18.4mol/L浓H2SO4和铜共热一段时间后,使反应混合物冷却,滤去多余的铜,将滤液加水定容到100mL,测得SO42-离子浓度为3.18mol/L。试求溶液中CuSO4的物质的量浓度。
27.(6分)某元素的同位素AZX,它的氯化物XCl2 3.33g溶于水制成溶液后, 加入1mol/L的AgNO3溶液60mL恰好完全反应.若这种同位素原子核内有20个中子,求:
(1)Z值和A值;
(2)X元素在周期表中的位置;
拦江中学08级高一化学第二学期期中考试试题参考答案
一. 选择题 1 B 2 C 3 C 4 B 5 B 6 C 7 B 8 C 9 D 10 C
11 C 12 D 13 D 14 C15 C 16 D 17 D 18 C 19 B 20 D
二.简答题
21.(共4分)
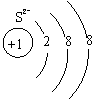 (2)14
(2)14
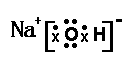 |
(4) (1)
(3) 略,
22. (6分) (1)SO2、CO2,H2O
(2) H2O, SO2、CO2
(3) SO2、CO2, H2O
23. (共3分) 1/4
24. (1)(共6分) X:H Y:O Z:Mg W:Cl
(2) Mg(OH)2+2HClO4=Mg(ClO4)2+2H2O
25.(11分)⑴Na2SO3+H2SO4=Na2SO4+H2O+SO2↑
⑵紫色石蕊试液变红,酸性
⑶品红褪色, 漂白性
⑷出现淡黄色浑浊, 氧化性
⑸溴水褪色, 还原性
⑹吸收多余的SO2,SO2+2NaOH=Na2SO3+H2O
三.计算题
26.(共5分) 0.5
27. (共5分) (1)Z=20 A=40
(2)第四周期,ⅡA族