武汉市部分重点中学2005——2006学年度下学期期中联考
高 一 年 级 化 学 试 卷
命(审)题学校:汉阳一中 命题人:杨家启 审题人:刘华章、兰全国
说明:
1. 本卷分第I卷(选择题)和第Ⅱ巷(非选择题)两部分,满分110分,考试时间90分钟。
2. 答题前,考生务必将自己的学校、姓名、考号填写在试卷指定位置。
3. 答案写在各题指定的答题处。
4. 本卷可能用到的相对原子质量如下:
H:1 He:4 Na:23 Li:7 Mg:24 Ba:137 Al:27 Fe:56 K:39 Cu:64 Ag:108 C:12 O:16 S:32 Cl:35.5 Br:80 N:14 P:31
第I卷 选择题 (共54分)
一、选择题(每小题3分,共54分,每小题只有一个正确答案):
1. 下列各组微粒中,核外电子总数相等的是
A. K+和Na+ B. CO2和NO2 C. CO和CO2 D. N2和CO
2.某微粒用![]() n+表示,下列关于该微粒的叙述中正确的是
n+表示,下列关于该微粒的叙述中正确的是
A. 所含质子数=A-n B. 所含中子数=A-Z
C. 所含电子数=Z+n D. 质子数=Z+A
3.周期表中16号元素和4号元素的原子相比较,前者的下列数据是后者的4倍的是
A.中子数 B.最外层电子数
C.电子层数 D.次外层电子数
4.![]() 和
和![]() 原子的核外电子数
原子的核外电子数
A. 大于 B. 小于 C. 等于 D. 不能确定
5.X和Y两元素的阳离子具有相同的电子层结构,X元素的阳离子半径大于Y元素的阳离子半径;Z和Y两元素的原子核外电子层数相同,Z元素的原子半径小于Y元素的原子半径。X、Y、Z三元素原子序数的关系是
A. Z>Y>X B. Y>X>Z C. Z>X>Y D. X>Y>Z

 6.下列四图中,白球代表氢原子,黑球代表氦原子。表示等质量的氢气与氦气混合气体的是
6.下列四图中,白球代表氢原子,黑球代表氦原子。表示等质量的氢气与氦气混合气体的是


A. B. C. D.
7.NaHSO4溶于水的过程中,发生了变化的化学键有
A. 离子键 B. 共价键
C. 既有离子键、又有共价键 D. 化学键未发生变化
8.CS2是一种有恶臭的液体,把它滴入硫酸酸化的高锰酸钾溶液中,有硫析出,放出CO2气体,当生成0.5 mol CO2时,转移的电子为
A.1 mol B.2 mol C.3 mol D.4mol
9. 下列关于化学键的说法正确的是
A. 原子间的相互作用都是化学键
B. 只有相邻的两个原子间才能形成化学键
—1—
C. 化学键就是相邻的两个原子间的吸引作用
D. 化学键包括相邻的两个原子间的吸引和排斥两方面的强烈作用
10.某元素的原子最外层只有一个电子,它跟卤素结合时,可形成的化学键
A. 一定是共价键 B. 一定是离子键
C. 可能是共价键,也可能是离子键 D. 以上说法都不对
11. 下列元素的最高价氧化物溶于水一定能生成强碱的是
A. 原子次外层电子数是最外层电子数8倍的元素
B. 原子次外层电子数是最外层电子数2倍的元素
C. 原子次外层电子数是最外层电子数4倍的元素
D. 最外层电子数为1的元素
12.下列各组中的离子,能在溶液中大量共存的是
A. Na+、Cu2+、Cl-、SO42- B. Na+、Ca2+、CO32-、NO3-
C. Na+、H+、Cl-、HCO3- D. K+、Fe3+、SO42-、OH-
13. 有关过氧化氢(H2O2)的下列叙述不正确的是
A. H2O2的沸点比水高,但受热容易分解
B. H2O2中的氧元素为-1价,它的水溶液俗称双氧水,呈弱酸性
![]()
|
![]()
![]()
![]() D. H2O2的电子式是:H+[:O:O:]2-H+
D. H2O2的电子式是:H+[:O:O:]2-H+
14.用mgCu与足量的浓硫酸共热,当反应完毕后,生成VL的二氧化硫,则被还原的硫酸
A.m/64 mol B.V/11.2 mol C.V/22.4 mol D.49V/5.6 mol
15. 对以下事实解释错误的是
A.在蔗糖中加入浓硫酸后出现发黑现象,说明浓硫酸具有脱水性
B.氢气可以在氯气中燃烧,说明燃烧反应未必需要氧气参与
C.常温下,浓硫酸可以用铝罐贮存,说明铝与浓硫酸根本就不会反应
D.反应CuSO4+H2S==CuS↓+H2SO4能进行,说明CuS既不溶于水,也不溶于稀硫酸
16. 检验二氧化硫气体中有无二氧化碳气体,应采取的方法是
A.通过澄清石灰水 B.先通过足量小苏打溶液,再通过石灰水
C.通过品红溶液 D.先通过足量酸性高锰酸钾溶液,再通过澄清石灰水
17.下列离子方程式书写正确的是
A.二氧化硫与水反应:SO2 + H2O === 2H++SO32-
B.碳酸钙与盐酸反应:CO32-+2H+ === CO2↑+ H2O
C.铁与稀硫酸反应:Fe+2H+ === Fe2++H2 ↑
D.硫酸铜溶液与氢氧化钡溶液反应:Ba2+ + SO42-== BaSO4↓
18. 两份质量均为1克的硫粉,分别使之与足量的H2和O2完全反应,将产生的含硫化合物混合,最终可得硫粉
A. 2g B. 1.5g C. 1g D. 0.5g
—2—
第Ⅱ卷 非选择题 (56分)
二、填空题(本题共2小题,共21分):
19. (12分) 短周期主族元素A、B、C、D的原子序数依次增大,其中A、C同主族,B、C、D同周期,A原子的最外层电子数是次外层电子数的3倍,B是短周期元素中原子半径最大的主族元素。试回答下列问题:
⑴A的元素符号为: O ;D的原子结构示意图是:Cl的原子结构示意图;
⑵A、B、C三种元素形成的简单离子的半径由大到小的顺序是(用离子符号表示) S2- > O2- >。。
⑶A、B、C、D形成的化合物B2A2、CD2、D2A、DA2中各原子都满足最外层8电子结构的是 NaO SCl ClO (填写具体的化学式 )。(
⑷CA2与D元素的单质在水溶液中反应的化学方程式是:SO+ClO = 2HCl +HSO2分)。
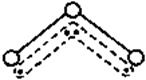 20.(9分)1994年度诺贝尔化学奖授予为研究臭氧作出特殊贡献的化学家。O3能吸收有害紫外线,保护人类赖以生存的空间。O3分子的结构如下图所示,呈V型,键角116.5℃。三个原子以一个O原子为中心,与另外两个O原子分别构成一个非极性共价键;中间O原子提供2个电子,旁边两个O原子各提供1个电子,构成一个特殊的化学键——三个O原子均等地享有这4个电子。请回答:
20.(9分)1994年度诺贝尔化学奖授予为研究臭氧作出特殊贡献的化学家。O3能吸收有害紫外线,保护人类赖以生存的空间。O3分子的结构如下图所示,呈V型,键角116.5℃。三个原子以一个O原子为中心,与另外两个O原子分别构成一个非极性共价键;中间O原子提供2个电子,旁边两个O原子各提供1个电子,构成一个特殊的化学键——三个O原子均等地享有这4个电子。请回答:
⑴臭氧与氧气的关系是: 同素异形体 。(2分)
⑵写出下列分子与O3分子的结构最相似的是: C 。(2分)
A.H2O B.CO2 C.SO2 D.BeCl2
⑶分子中某原子有1对没有跟其他原子共用的价电子叫孤对
电子,那么O3分子有 5 对孤对电子。 (1分) ⑷
⑷O3分子是否为极性分子 (填“是”或“否”)。
⑸O3与O2间的转化是否为氧化还原反应 否 (若否,请回答A小题;若是,请回答B小题)A.O3具有强氧化性,它能氧化PbS为PbSO4而O2不能,试配平:
[ 1 ]PbS+[ 4 ]O3===[ 1 ]PbSO4+[ 4 ]O2 (2分)
B.O3在催化剂作用下生成1molO2,转移电子数为_________mol
三、实验题(本题共2小题,共19分):
21. (5分)检验SO42-应向被测溶液中先加入适量的盐酸,如果无明显变化,再滴入氯化钡(或氢氧化钡)溶液,观察到有白色沉淀生成,可判断原溶液中含有SO42-。如果向被测溶液中先滴加BaCl2溶液,有白色沉淀生成,再滴加稀盐酸,沉淀不消失,则该溶液除可能含SO42-外,还可能含有Ag+。如果向被测溶液中滴加Ba(NO3)2溶液,有白色沉淀生成,再滴加稀硝酸,白色沉淀不消失,则该溶液除可能含有SO42-外,还可能含有SO- 。
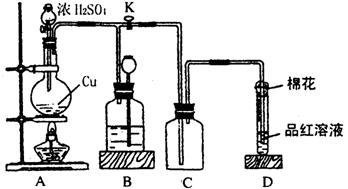
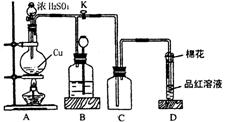 22.(14分)某化学兴趣小组为探究铜跟浓硫酸的反应,用右图所示装置进行有关实验。请回答:
22.(14分)某化学兴趣小组为探究铜跟浓硫酸的反应,用右图所示装置进行有关实验。请回答:
⑴装置A中发生的化学反应方程
式为: Cu + 2HSO (浓) CuSO + SO↑+ 2HO 。
⑵装置D中试管口放置的棉花中应浸一种液体,这种液体是碱液(其他合理答案均可给分) ,
其作用是吸收多余的二氧化硫,防止污染空气。
⑶装置B的作用是贮存多余的气体。当D处有明显的现象后,关闭旋塞K,移去酒精灯,但由于余热的作用,A处仍有气体产生,此时B中现象是_试剂(或广口)瓶中液面下降,长颈漏斗中液面上升。B中应放置的液体是(填字母)_d 。
a.水 b.酸性KMnO4溶液 c.浓溴水 d.饱和NaHSO3溶液
⑷实验中,取一定质量的铜片和一定体积18 mol · L – 1的浓硫酸放在圆底烧瓶中共热,直到反应完毕,发现烧瓶中还有铜片剩余,该小组学生根据所学的化学知识认为还有一定量的硫酸剩余。请回答下列问题:
①有一定量的余酸但未能使铜片完全溶解,你认为原因是_反应过程中浓硫酸被消耗,逐渐变稀,而铜不和稀硫酸反应 。
—3—
②下列药品中能用来证明反应结束后的烧瓶中确有余酸的是_a、d (填字母)。
a.铁粉 b.BaCl2溶液 c.银粉 d.Na2CO3溶液
四、推断题(本题共1小题,共10分):
23.(10分)有一种不溶于水的固体A,加热条件下A和H2反应生成气体B;A和O2在点燃条件下反应生成气体C;B与C两种气体相遇又生成固体A和水;将A与钠反应生成的白色固体D,D溶于稀盐酸,又生成气体B;B能使湿润的蓝色石蕊试纸变红,也能使溴水褪色生成固体A。试推断
⑴A,B,C,D的化学式:A___S______;B_HS ___;C_SO____;D__NaS __ 。(4分)
⑵写出下列反应方程式 :
B和C反应:___2HS +SO ==3S+2HO ______ ;(
D溶于稀盐酸: NaS + 2HCl ==2NaCl +HS↑ ;
B使溴水褪色: HS +Br ==2HBr + S↓ 。
五、计算题(本题共6分):
24.将1.95g由Na2SO4和Na2CO3组成的混合物溶于水得溶液A,在A中加入10mL未知浓度的BaCl2溶液恰好完全反应,过滤得沉淀B,向B中加入足量稀硫酸,沉淀不消失反而增加0.18g。计算:
(1)原混合物中Na2CO3的质量分数。(保留三位小数)
(2)BaCl2溶液的物质的量浓度。
—4—
 武汉市部分重点中学2005—2006学年度下学期期中联考
武汉市部分重点中学2005—2006学年度下学期期中联考
高一年级化学答题纸
第I卷 选择题(共54分)
一、选择题:(每小题只一个正确答案,每小题3分)
| 题号 | 1 | 2 | 3 | 4 | 5 | 6 | 7 | 8 | 9 | 10 |
| 答案 | A | C | CA | D | AB | DC | DD | A | D | |
| 题号 | 11 | 12 | 13 | 14 | 15 | 16 | 17 | 18 | 得分 | |
| 答案 | B | D | B | C | A | B | D | B |
| |
第Ⅱ卷 非选择题(共56分)
| 题号 | 二 | 三 | 四 | 五 | 总分 |
| 得分 |
|
|
|
|
|
第Ⅱ卷 非选择题 (56分)
二、填空题(本题共2小题,共21分):
| |||
 | |||
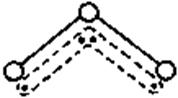 20.(9分)
20.(9分)
⑴臭氧与氧气的关系 是: 。
⑵ 。
⑶ 。
⑷ ____(填“是”或“否”)。
⑸ (若否,请回答A小题;若是,请回答B小题)
A.[ ]PbS+[ ]O3===[ ]PbSO4+[ ]O2
B.___________mol
![]()
—1—
|
![]()
![]()
![]() 22.(14分)
22.(14分)
⑴: 。
⑵ ,
其作用是 。
⑶现象是: 。
B中应放置的液体是(填字母)_ 。
⑷①你认为原因是: 。
②_ (填字母)。
![]()
四、推断题(本题共1小题,共10分):
![]()
![]()
![]() 23.(10分)
23.(10分)
⑴A_________;B__ ___;C_____ ;D__ __ 。
⑵写出下列反应方程式 :
B和C反应:___ ______ ;
D溶于稀盐酸: ;
![]() B使溴水褪色:
。
B使溴水褪色:
。
![]()
![]()
![]() 五、计算题(本题共6分):
五、计算题(本题共6分):
24.(1)原混合物中Na2CO3的质量分数。
(2)BaCl2溶液的物质的量浓度。
![]()
—2—
武汉市部分重点中学2005—2006学年度下学期期中联考
高一年级化学答案
第I卷 选择题(共54分)
一、选择题:(每小题3分,共计54分)
1.D 2.B 3.D 4.C 5.A 6.B 7.C 8.B 9.D 10.C 11.A 12.A 13.D 14.A 15.C 16.D 17.C 18.B
第Ⅱ卷 非选择题 (56分)
二、填空题(本题共2小题,共21分):
19. (12分)
⑴ O ;Cl的原子结构示意图。 (每空1分共2分)
⑵ S2- > O2- > Na+ 。 (2分顺序错0分)
⑶ Na2O2 、SCl2 、Cl2O 。 (每空2分共6分)
⑷SO2 +Cl2 + 2H2O = 2HCl +H2SO4 (2分)。
20.(9分)
⑴ 同素异形体 。 (2分) ⑵ C 。 (2分)
⑶ 5 (1分) ⑷ 是____。 (1分)
⑸ 否 (1分)
A.[ 1 ]PbS+[ 4 ]O3===[ 1 ]PbSO4+[ 4 ]O2 (2分)
B.O3在催化剂作用下生成1molO2转移电子数___________mol
三、实验题(本题共2小题,共19分):
21. (5分) 盐酸, 氯化钡(或氢氧化钡), 白色沉淀, Ag+。 SO32-。
(每空1分共5分)
22.(14分)(每空2分)
⑴ Cu + 2H2SO4 (浓) ![]()
⑵碱液(其他合理答案均可给分) ,
吸收多余的二氧化硫,防止污染空气 。
⑶_试剂(或广口)瓶中液面下降,长颈漏斗中液面上升。 _d 。
⑷①_反应过程中浓硫酸被消耗,逐渐变稀,而铜不和稀硫酸反应 。 ②_a、d 。
四、推断题(本题共1小题,共10分):
23.(10分)⑴A___S______;B__H2S ___;C_SO2 ____;D__Na2S __ 。(4分)
⑵___2H2S +SO2 ==3S+2H2O _______ ;(2分)
Na2S + 2HCl ==2NaCl +H2S↑ ;(2分)
H2S +Br2 ==2HBr + S↓ 。 (2分)
五、计算题(本题共6分):
24.(1)27.2% ( 或0.272) (3分) (2)1.5mol•L-1 (3分) (没有写单位不给分)
(只要方法正确,结论正确均得满分)