江苏省新海高级中学2005-2006学年度第二学期阶段考试
高一年级化学试卷
命题人:陈会用 审校人:孙成红
本卷分第Ⅰ卷(选择题)和第Ⅱ卷(非选择题)两部分,满分100分,时间90分钟。
供选用的相对原子质量:H—1 C—12 N—14 Na—23 Mg—24 Al—27 S—32 Cl—35.5 Cu—64 Fe—56 O—16 Br—80
第Ⅰ卷 (选择题,共48分)
一、选择题(本题包括6小题,每小题2分,共12分,每小题只有一个选项符合题意)
1.19世纪中叶,门捷列夫的突出贡献是
A.提出原子学说 B.发现元素周期律 C.提出分子学说 D.发现氧气
2.元素的种类和原子的种类
A.前者大 B.后者大 C.相同 D.无法确定
3.下列说法正确的是:①氘和氚是中子数不同、质子数相同的氢的两种同位素
②氢元素是指![]() H ③
H ③![]() H、
H、![]() H、
H、![]() H是同一元素的三种不同核素
④
H是同一元素的三种不同核素
④![]() H和
H和![]() H的化学性质几乎完全相同
H的化学性质几乎完全相同
A.②③ B.③④ C.①③④ D.②③④
4.关于化学键的下列叙述正确的是:
A.离子化合物中不可能含有共价键 B.两种不同原子形成的共价键一定是极性共价键
C.共价化合物中不可能含有离子键 D.非金属元素形成的化合物中不可能含有离子键
5.下列叙述不正确的是
A.充电电池又称二次电池 B.风力是由太阳能转化来的是二次能源
C.天然气是一次能源 D.燃料电池是一种高效、环境友好的发电装置
6.元素的性质呈周期性变化的根本原因是
A.元素相对原子质量的递增,量变引起质变 B.元素的原子半径呈周期性变化
C.元素原子的核外电子排布呈周期性变化 D.元素的金属性和非金属性呈周期性变化
二、选择题(本题包括12小题,每小题3分,共36分。每小题有1—2个选项符合题意)
7.根据硼(B)在元素周期表中的位置推测,硼的最高价氧化物的水化物的化学式不可能是
A.H2BO4 B.H3BO3 C.HBO2 D.H2B4O7
8.已知R n-离子中有 x 个电子,y 个中子,表示 R 原子的符号正确的是:
A.![]() B.
B.![]() C.
C.![]() D.
D.![]()
9.下列关于氯离子的表示方法,错误的是
A.Cl- B.![]() C.
C.![]() D.
D.![]()
10.以下叙述与分子间作用力大小无关的是
A.气态物质加压降温时凝结成液体 B.干冰(CO2)易升华
C.F2、Cl2、Br2 、I2熔沸点依次升高 D.NaCl的熔点较高
11.下列各表分别是元素周期表一部分,表中的数字表示元素的原子序数,各表中数字所表示的元素在周期表中的位置与周期表的结构相符的是:
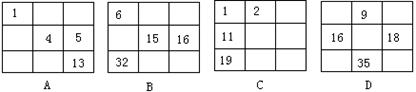 |
12.某元素X的原子核外电子数等于核内中子数,取2.8 g 该元素的单质与氧气充分作用,可得到6 g化合物XO2。该元素在周期表中的位置是
A.第三周期 B.第二周期 C.第Ⅳ主族 D.第Ⅴ主族
13.已知碳有两种常见的同位素12C、13C;氧也有常见的三种同位素16O、17O、18O。由这5种核素构成的二氧化碳分子中,其相对分子质量最多可能有
A.6种 B.10种 C.11种 D.12种
14.下列有关化学反应的能量变化的说法正确的是
A.需要加热才能发生的反应一定是吸热反应
B.放热反应在常温下一定很容易发生
C.反应是放热还是吸热,是由反应物和生成物所具有的总能量的相对大小决定的
D.拆开1mol反应物化学键吸收的能量小于生成1mol生成物化学键放出的能量,该反应是放热反应
15.实验室中制取氢气,反应最快的是
A.纯锌与6 mol·L-1硫酸反应 B.纯锌与18.4 mol·L-1浓硫酸反应
C.纯锌与6 mol·L-1盐酸反应 D.粗锌(含铜、银)与6 mol·L-1硫酸反应
16.下列说法中,正确的是
A.双原子分子中的共价键,一定是非极性键 B.非极性键也可能存在于离子化合物中
C.HCl分子中只有一对共用电子对,H2S分子中有两对共用电子对,故H—Cl键的极性比H—S键的极性弱
D.I2单质的升华、NaCl晶体熔化、HCl气体溶于水时,均不需要破坏化学键
17.X、Y、Z和R分别代表四种元素,如果aXm+、bYn+、cZn-、dRm-四种离子的电子层结构相同,则下列关系正确的是
A.a-c = m-n B.a-b = n-m C.c-d = m+n D.b-d = n+m
18.a、b、c、d四种主族元素,a、b元素的简单阳离子和c、d元素的简单阴离子都具有相同的电子层结构,且a的阳离子氧化性小于b的阳离子的氧化性,c的阴离子所带的负电荷数小于d的阴离子所带负电荷数。则下列说法正确的是:
A.原子序数:b>a>d>c B.原子半径:b>a>d>c
C.c的气态氢化物的稳定性大于d的气态氢化物的稳定性
D.a的最高价氧化物的水化物的碱性大于b的最高价氧化物的水化物的碱性
 请将第Ⅰ卷答案填写在下列表格中
请将第Ⅰ卷答案填写在下列表格中
| 题号 | 1 | 2 | 3 | 4 | 5 | 6 |
| |||||
| 答案 |
|
|
|
|
|
|
| |||||
| 题号 | 7 | 8 | 9 | 10 | 11 | 12 | 13 | 14 | 15 | 16 | 17 | 18 |
| 答案 |
|
|
|
|
|
|
|
|
|
|
|
|
第Ⅱ卷(非选择题,共52分)
三、填空题(本题包括6小题,共46分)
19.(1)(5分)用A.质子数B.中子数C.核外电子数D.最外层电子数 E.电子层数,填写下列空格。
①核素种类由________决定;②元素种类由________决定;③元素的化学性质主要由________决定;④元素的周期数由 决定;⑤离子所带电荷数由 决定。
(2)(5分)构成下列化合物的化学键是(用离子键、极性键、非极性键):
①NaCl ,②Na2O2 ,③NH4Cl 。
20.(5分)下列结论正确的是
①微粒半径:S2->Cl>S>F; ②氢化物稳定性:HF>HCl>H2S>H2Se; ③离子还原性:S2->Cl-> Br->I-; ④氧化性:Cl2>S>Se>Te; ⑤酸性:H2SO4>HClO4>H2SeO4; ⑥非金属性:F>Cl>S>Se ⑦碱性:NaOH>Mg(OH)2>Al(OH)3 ⑧原子半径:Na<Mg<Al ⑨离子氧化性:Na+<Mg2+<Al3+ ⑩单质的还原性:Al>Mg>Na
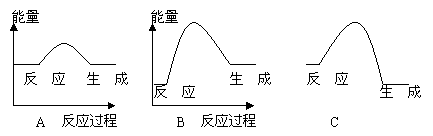
 21.(3分)下列各图表示正反应是吸热反应的是:
21.(3分)下列各图表示正反应是吸热反应的是:
22.(18分)A、B、C、D、E、F六种短周期元素的原子序数依次增大,已知:
①A原子核内只有1个质子;②B原子最外层电子数是次外层电子数的2倍;③C原子最外层电子数比次外层电子数多4个;④D原子的次外层电子数是最外层电子数的8倍;⑤E单质既能和盐酸反应又能和烧碱反应;⑥F与C同主族。用化学符号或化学用语回答下列问题:
(1)写出F离子的结构示意图 ;
(2)用电子式表示下列物质BC2 ,D2C2_________________;
(3)用电子式表示D与F形成化合物的过程 ;
(4)用“化学式”和“< >”比较A与C、A与F形成化合物的稳定性 ,沸点的高低 ,沸点高低的原因 ;
(5)分别写出E的最高价氧化物对应水化物与D和F的最高价氧化物对应水化物反应的离子方程式:
。
23.(5分)现有原子序数之和为51的五种短周期元素A、B、C、D、E。已知:A、B、E、C、D原子序数依次增大;A的单质在常温下为无色气体;B原子的最外层电子数比次外层电子数多3个;C和B同主族;D的最高价氧化物的水化物的酸性在同主族元素中是最强的,E元素最外层电子数与其K层电子数相同.
(1)试写出它们的元素符号: C______、D______、E______;
(2)写出A与B反应的生成物的电子式是________________,结构式是____ _______。
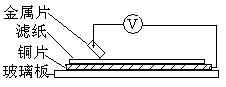 24.(5分)将洁净的金属片A、B、C、D分别放置在浸有NaCl溶液的滤纸上面并压紧(如图)。在每次实验时,记录电压表指针的偏转方向和电压的读数如下:
24.(5分)将洁净的金属片A、B、C、D分别放置在浸有NaCl溶液的滤纸上面并压紧(如图)。在每次实验时,记录电压表指针的偏转方向和电压的读数如下:
| 金属 | 电子流动方向 | 电压 |
| A | A→Cu | +0.78 |
| B | Cu→B | -0.15 |
| C | C→Cu | +1.35 |
| D | D→Cu | +0.30 |
已知:构成两电极的金属活动性相差越大,电压表的读数越大。请依据表中数据判断:
(1)还原性最强的金属是 ;一定不能从硫酸铜溶液中置换出铜的金属是 。
(2)在滤纸上能看到有蓝色沉淀析出的是 (填字母)金属,其对应的原电池的电极反应为:
负极: 正极: 。
四、计算题(6分)
25.某氯化钠晶体是由Na+、35Cl-和37Cl-组成,在熔融状态下电解,生成的氯气对甲烷的相对密度为4.525(同温同压)求这种NaCl晶体中37Cl-的离子数约占阴离子总数的百分数。
江苏省新海高级中学2005-2006学年度第二学期阶段考试
高一年级化学试卷答案卷
| 题号 | 1 | 2 | 3 | 4 | 5 | 6 |
| |||||
| 答案 | B | A | C | C | B | C |
| |||||
| 题号 | 7 | 8 | 9 | 10 | 11 | 12 | 13 | 14 | 15 | 16 | 17 | 18 |
| 答案 | A | C | C | D | AD | AC | A | C | D | C | D | CD |
19.(1)①AB ②A ③D ④E ⑤AC (2)①A ②AC ③AB
20.② ④ ⑥ ⑦ ⑨
![]()
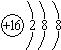 21.B
21.B
![]() 22.(1) (2)
22.(1) (2)
![]()
(3)
(4)H2O>H2S H2O>H2S H2O分子间存在着氢键,分子间作用力大,故沸点高
(5)Al(OH)3 + OH- = AlO-2 + 2H2O Al(OH)3 + 3H+ = Al3+ + 3H2O
23.(1)P、S、Mg (2) ![]()
24.(1)C B (2)B 2Cu - 4e- = 2Cu2+ O2 + 2H2O + 4e- = 4OH-
25.Mr(Cl2) = 4.525×16 = 72.4
Ar(Cl) = ![]() = 36.2
= 36.2
35Cl 35 0.8
╲ ╱
36.2
╱ ╲
37Cl 37 1.2
n(35Cl)∶n(37Cl) = 2∶3
ω(37Cl-) = ![]() ×100% = 60%
×100% = 60%