2004~2005学年度第二学期高一期末考试
化 学 试 卷
可能用到的相对原子质量:H 1 C 12 O 16 Al 27 S 32
第Ⅰ卷 (选择题 共63分)
一、选择题(本题包括9小题,每题3分,共27分。每小题只有一个选项符合题意。)
1. 科学家最近合成出了质子数为114的原子,该原子的质量数为289,存在时间为25秒,这项成果具有重要意义。该原子的中子数与电子数之差是
A.175 B.114 C.61 D.289
2. 长式元素周期表中,所含元素种类最多的族是
A.Ⅷ族 B.ⅠA族 C.0族 D.ⅢB族
3. 物质间发生化学反应时,一定发生变化的是
A.颜色 B.状态 C.化学键 D.原子核
4. 有认认为在长式周期表中,位于IA族的氢元素,也可以放在 ⅦA族,下列物质支持这种观点的是
A.HF B.H3O+ C.NaH D. H2O2
5. 通常用来衡量一个国家的石油化学工业发展水平的标志是
A.石油产量 B.乙烯的产量
C.合成纤维的产量 D.硫酸的产量
6. 燃烧相同质量的甲烷,生成CO2气体和液态水时放出的热量为Q1,生成CO2气体和气态水放出的热量为Q2,则Q1和Q2的关系是
A.大于 B.相等 C.小于 D.无法确定
7. 利用下列反应不能制得括号中纯净物质的是
A.乙烯与氯气加成(1,2-二氯乙烷)
B.乙烯与水加成(乙醇)
C.等物质的量的氯气与乙烷在光照条件下反应(氯乙烷)
D.氯气与苯用氯化铁作催化剂反应(氯苯)
8. 某温度下,浓度都是1 mol/L的两种气体X2和Y2,在密闭容器中反应生成气体Z,经过t min后,测得物质的浓度分别为C(X2)=0.4mol/L,C(Y2)=0.8mol/L,C(Z)=0.4mol/L,则该反应式可表示为
A.X2+2Y2==2XY2 B.2X2+Y2==2X2Y
C.3X2+Y2==2X3Y D.X2+3Y2==2XY3
9. 氢气是21世纪极有前途的新型能源,是各国研究的热点之一。氢能开发的首要问题是研究如何以水为原料制取氢气。以下研究方向你认为可行的是
A.大量建设水电站,用电力分解水制取氢气。
B.设法将大阳能聚焦,产生高温,使水分解产生氢气。
C.寻找更多的化石燃料,利用其燃烧放热,使水分解产生氢气。
D.寻找特殊化学物质,用于开发廉价能源,以分解水制取氢气。
二、选择题(本题包括9小题,每小题4分,共36分。每小题有一个或两个选项符合题意,漏选给2分;多选、错选不给分。)
10.砹是原子序数最大的卤族元素,根据卤素性质的递变规律,对砹及其化合物的叙述不正确的是
A.非金属性在卤素中是最弱的,At- 易被氧化
B.NaAt的熔点较高
C.砹在常温下为白色固体
D.砹易溶于水,难溶于四氯化碳
11.有A、B、C、D四块金属片,进行如下实验:①A、B用导线相连后,同时浸入稀硫酸溶液中,A极为负极;②C、D用导线相连后,同时浸入稀硫酸溶液中,电流由D通过导线流向C;③A、C相连后,同时浸入稀硫酸溶液中,C极产生大量气泡;④B、D相连后,同时浸入稀硫酸溶液中,D极发生氧化反应。据此,判断四种金属的活动顺序是A.A>B>C>D B.A>C>D>B C.C>A>B>D D.B>D>C>A
12.把100 ml 6 mol/L的稀硫酸跟过量的铝粉反应,在一定温度下,为了减慢反应速率而不影响生成的氢气的总量,可在反应物中加入适量的
A.CuSO4固体 B.NaOH固体 C.K2SO4溶液 D.水
13.已知化合物[Pt(NH3)2Cl2]分子里的Pt、NH3、Cl等原子或原子团都在同一平面里,与[Pt(NH3)2Cl2]这一分子式相对应的有如下两种异构体:
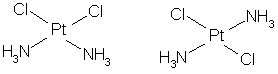
能说明甲烷分子是以碳原子为中心的正四面体形结构,而不是以碳原子为中心的平面正方形结构的理由
A.CH4中的四个价键的键角和键长都相等
B.CH3Cl不存在同分异构体
C.CH2Cl2不存在同分异构体
D.CHCl3不存在同分异构体
14.区别植物油和矿物油的正确方法是
A.加水振荡,观察是否有分层现象
B.加乙醇振荡,观察是否发生分层
C.加新制的Cu(OH)2悬浊液,加热,观察有无砖红色沉淀生成
D.加入含有酚酞的NaOH溶液,加热,观察溶液红色是否变浅
15.已知甲酸甲酯的结构简式为HCOOCH3,下列有关甲酸甲酯的性质叙述错误的是
A.甲酸甲酯是一种具有香味的有机物质
B.甲酸甲酯可由甲酸和甲醇在一定条件下发生酯化反应制得,酯化反应时甲酸脱去氢原子,甲醇脱去羟基
C.甲酸甲酯在酸性和碱性条件下都可以发生水解
D.甲酸甲酯在一定条件下可以与新制的Cu(OH)2悬浊液反应
16.葡萄糖和淀粉的混合物中氢的质量分数为6.5%,则混合物中碳的质量分数为
A.13.0% B.39.0% C.41.5% D.52%
17.误食用铜、铅或汞盐中毒后,应采取的急救措施是
A.服用大量葡萄糖水 B.服用大量牛奶
C.服用大量鸡蛋清 D.服用适量食醋
18.碳氢化合物是一种大气污染物,下列的现象的产生与碳氢化合物有关的是
A.臭氧层空洞 B.酸雨 C.光化学污染 D.温室效应
| 题号 | 1 | 2 | 3 | 4 | 5 | 6 | 7 | 8 | 9 |
| 答案 | |||||||||
| 题号 | 10 | 11 | 12 | 13 | 14 | 15 | 16 | 17 | 18 |
| 答案 |
第Ⅱ卷(非选择题 共57分)
三、填空题(2小题,共12分)
![]() 19.(3分)生产面粉的工厂都要挂上“严禁烟火”的牌子,试从燃料充分燃烧的条件出发分析其原因
19.(3分)生产面粉的工厂都要挂上“严禁烟火”的牌子,试从燃料充分燃烧的条件出发分析其原因
![]()
20.(9分)有下列七中物质:A.干冰 B.氧化镁 C.氯化铵
D.固态碘 E.烧碱 F.冰 G.过氧化钠
![]() (1)熔化时需要破坏共价键的是
(填序号,下同)
(1)熔化时需要破坏共价键的是
(填序号,下同)
![]() (2)熔点最低的是
(2)熔点最低的是
![]() (3)既有离子键又有共价键的是
(3)既有离子键又有共价键的是
![]() (4)只含极性键的是
(4)只含极性键的是
![]() (5)含非极性键的是
(5)含非极性键的是
四、实验题(2小题,共17分)
21.(9分)某学生设计了三个实验方案,用以检验淀粉的水解情况:
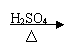 | 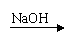 | 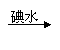 |
方案甲:淀粉液 水解液 中和液 溶液变蓝
结论:淀粉完全没有水解
 | |||
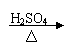 | |||
方案乙:淀粉液 水解液 无银镜
结论:淀粉没有发生水解
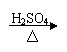 |  |  |
方案丙:淀粉液 水解液 中和液 有银镜现象
结论:淀粉已经水解
根据上述操作、现象,首先回答结论是否正确,然后简要说明理由:
(1)方案甲 理由是
![]() (2)方案乙
理由是
(2)方案乙
理由是
![]() (3)方案丙
理由是
(3)方案丙
理由是
22.(8分)镁及其合金是一种用途很广的金属材料,目前世界上60%的镁是从海水中提取的。主要步骤如下:
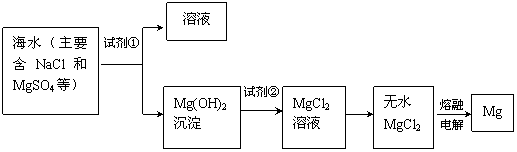
![]() (1)为了使MgSO4转化为Mg(OH)2,试剂①可以选用 (A.NaOH B.Ca(OH)2),要使Mg(OH)2完全转化为沉淀,加入试剂①的量应
;
(1)为了使MgSO4转化为Mg(OH)2,试剂①可以选用 (A.NaOH B.Ca(OH)2),要使Mg(OH)2完全转化为沉淀,加入试剂①的量应
;
![]() (2)加入试剂①后,能够分离得到Mg(OH)2沉淀的方法是
;
(2)加入试剂①后,能够分离得到Mg(OH)2沉淀的方法是
;
![]() (3)试剂②可以选用
;
(3)试剂②可以选用
;
![]() (4)无水MgCl2在熔融状态下,通电后会产生Mg和Cl2,写出该反应的化学方程式
(4)无水MgCl2在熔融状态下,通电后会产生Mg和Cl2,写出该反应的化学方程式
![]() (5)上述工艺流程中,得到Mg(OH)2沉淀后,为什么不可直接加热得到MgO,然后电解MgO制得金属镁,这样还可以节省试剂?原因是
(5)上述工艺流程中,得到Mg(OH)2沉淀后,为什么不可直接加热得到MgO,然后电解MgO制得金属镁,这样还可以节省试剂?原因是
五、推断题(2小题,15分)
23.(6分)AB2离子化合物的阴、阳离子的电子层结构相同,每1摩尔AB2中含有54 mol电子,根据下列反应:① H2 +B2![]() C ② B2 + X
C ② B2 + X![]() Y + AB2 + H2O ③ Y + C
Y + AB2 + H2O ③ Y + C![]() AB2 + Z, Z有漂白作用。
AB2 + Z, Z有漂白作用。
(1)写出下列物质的化学式
AB2 X Y Z
![]()
![]()
![]()
![]()
(2)写出反应的离子方程式
![]()
24.(9分)A、B、C是大家熟悉的与生命运动密切相关的三种化合物,它们所含元素不超过三种,并有下列转化关系
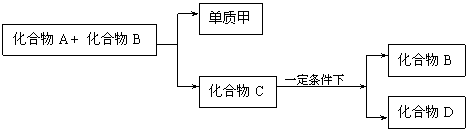
回答下列问题:
(1)在A、B、C、D四种化合物中,所含元素种类完全相同的是 (写字母代码和物质名称)
![]()
(2)常温下,A和B是通过 途径转化为C的;
![]() (3)目前,化合物B在自然界中的含量呈上升趋势,对环境产生了不良影响,发生这种变化的主要原因是
(3)目前,化合物B在自然界中的含量呈上升趋势,对环境产生了不良影响,发生这种变化的主要原因是
六、计算题(1个小题,共13分)
25.在1.01×105pa,273℃下,1.48g有机物A的体积为0.896L,完全燃烧后生成物是二氧化碳和水蒸气,两者的体积比是4:5(在同温同压下测定),总质量是5.32g。已知A能与金属钠反应,其氧化产物能发生银镜反应。试写出A可能的结构简式。
2004~2005学年度高一第二学期期末考试
化学试卷(参考答案及评分标准)
第Ⅰ卷(选择题)
| 题号 | 1 | 2 | 3 | 4 | 5 | 6 | 7 | 8 | 9 |
| 答案 | C | D | C | C | B | A | C | C | BD |
| 题号 | 10 | 11 | 12 | 13 | 14 | 15 | 16 | 17 | 18 |
| 答案 | CD | B | CD | C | D | B | C | BC | C |
第Ⅱ卷(非选择题,共57分)
19.(3分)因为面粉厂内空气中的淀粉颗粒很多(1分),与空气中O2接触面很大(1分),如遇到烟火它就会发生燃烧甚至引起爆炸(1分)
20.(9分)(1)C(2)A(3)CEG(4)AF(5)DG (每选对1个给1分,多选、错选不给分)
21.(9分)(1)结论不正确(1分),因为淀粉可能部分水解,未水解的残留淀粉会与碘水反应而变蓝(2分)。
(2)结论不正确(1分),因为淀粉可能部分水解或完全水解,但酸性条件下,生成的葡萄糖不能与银氨溶液发生银镜反应(2分)。
(3)结论正确(1分),说明淀粉已水解,生成了葡萄糖,并在碱性条件下产生了银镜反应(2分)。
22.(8分)(1)A ,适过量 每空1分)(2)过滤(1分)(3)盐酸(1分)
(4)MgCl2![]() Mg
+ Cl2↑ (2分)
Mg
+ Cl2↑ (2分)
(5)MgO的熔点比MgCl2的熔点高,熔融时所需要的热量多 (2分)
23.(6分)(1)CaCl2 Ca(OH)2 Ca(ClO)2 HClO (每空1分)
(2)Cl2 + 2OH- == Cl- + ClO- + H2O (2分)
24.(9分)(1)C:葡萄糖 D:乙醇 (4分)
(2)植物的光合作用 (2分)
(3)大量燃烧含碳燃料、人口膨胀、森林被大面积砍伐等 (3分)
25.(13分)解:设A的摩尔质量为M g/mol
n=1.48/M=0.448/22.4 =0.02 (mol) (1分)
M=74g/mol (1分)
n(C)=5.32*4/(4*44+5*18)=0.08(mol) (1分)
n(H)=(0.08/4)*5*2=0.2(mol) (1分)
n(O)=(1.48-0.08*12-0.2*1)/16=0.02(mol) (1分)
n(C)/n=0.08/0.02=4, n(H)/n=0.2/0.02=10, n(O)/n=0.02/0.02=1
所以,A的分子式为C4H10O (2分)
A能与金属钠反应,其氧化产物能发生银镜反应,可知A为醇
所以,A的结构简式可能为:
![]()
(CH3)3COH(每个结构简式2分,4个写出3个即可得满分6分)