第二节 钠的化合物
Ⅰ.学习重点:
1.掌握氧化钠、过氧化钠的性质
2.掌握碳酸钠和碳酸氢钠的性质及其鉴别方法
3.了解钠的重要化合物的用途
Ⅱ.学习难点:
过氧化钠与二氧化碳的反应
Ⅲ.训练习题
一、选择题
1.下列物质露置在空气中质量不会增加的是( )
A.Na2O B.Na2O2 C.Na2CO3 D.NaOH
2.与水作用生成碱并有气体放出的是( )
A.Na2O B.SiO2 C.Na D.Na2O2
3.下列各组中的两种物质作用时,反应条件或反应物的用量比改变,生成的化合物不会改变的是( )
A.钠与氧气 B.氢氧化钠与二氧化碳
C.氧化钠与二氧化碳 D.过氧化钠与水反应
4.下列说法正确的是( )
A.1g钠投入100g水中,溶液的总质量为100g
B.1g表面被氧化的金属钠投入100g水中,溶液的总质量为101g
C.1g氧化钠投入100g水中,溶液的总质量为101g
D.1g过氧化钠投入100g水中,溶液的总质量为101g
5.要除去硫酸钠里混有少量的碳酸钠,应加入的物质是( )
A.氯化钡溶液 B.稀硫酸 C.石灰水 D.氢氧化钠
6.关于NaHCO3的性质,下列说法正确的是( )
A.和酸反应放出等量的CO2所消耗的酸比Na2CO3少
B.相同温度下溶解度比NaCO3要大
C.热稳定性比Na2CO3小
D.NaHCO3只能和酸作用不能和碱作用
7.将下列固体物质放在空气中,逐渐变成溶液后又变成粉末的是( )
A.Na2CO3 B.KNO3
C.Na2CO3·10H2O D.NaOH
8.下列离子方程式正确的是( )
A.钠与水反应2Na+2H2O![]() 2Na++2OH-+H2↑
2Na++2OH-+H2↑
B.氧化钠与盐酸反应 O2-+2H+![]() H2O
H2O
C.碳酸氢钠与稀硫酸反应:CO32-+2H+![]() CO2↑+H2O
CO2↑+H2O
D.NaOH溶液与小苏打溶液反应 HCO3-+OH-![]() CO32-+H2O
CO32-+H2O
9.欲除去小苏打溶液中少量的Na2CO3杂质,最易选用加入的物质是( )
A.干冰 B.盐酸 C.碳酸氢钙 D.氢氧化钙
10.在天平的两个托盘上,分别放上质量相等的两个烧杯,在烧杯中分别加入等质量的质量分数相等的硫酸,此时天平处于平衡状态,然后分别向两只烧杯中加入等质量的NaHCO3和Na2CO3粉末,待Na2CO3和NaHCO3完全反应,则天平两边( )
A.放Na2CO3的一端托盘下沉 B.放NaHCO3的端托盘下沉
C.仍保持平衡 D.无法判断
11.由四种不纯的纯碱样品,分别含有下列一种杂质,取等质量的四种样品分别与等质量分数的盐酸反应,所消耗盐酸的质量相等,则这四种样品中含纯碱质量分数最大的是含有杂质( )
A.NaHCO3 B.KHCO3 C.K2CO3 D.NH4HCO3
12.某容器中通入V LCO2,再加入少量Na2O2后,气体体积缩小到W L,则被吸收的CO2的体积是(均为相同条件下)( )
A.(V—W)L B.2(V—W)L C.(2V—W)L D.2WL
13.已知NaOH中Na为+1价,对于NaH+H2O![]() NaOH+H2↑下列说法正确的是( )
NaOH+H2↑下列说法正确的是( )
A.H2都是还原产物 B.H2都是氧化产物
C.NaH中的氢元素被氧化 D.氧化产物与还原产物质量相等
14.在一定温度下,向饱和Na2CO3溶液中加入1.06g无水Na2CO3,搅拌后静置,最终所得晶体的质量为( )
A.等于1.06g B.大于2.86g
C.等于2.86g D.大于1.06g小于2.86g
15.在下列反应中,Na2O2只表现出强氧化性的是( )
A.2Na2O2+CO2![]() 2Na2CO3+O2
2Na2CO3+O2
B.Na2O2+MnO2![]() Na2MnO4
Na2MnO4
C.2Na2O2+H2SO4![]() 2Na2SO4+2H2O+O2↑
2Na2SO4+2H2O+O2↑
D.5Na2O2+2MnO4-+16H+![]() 10Na++2Mn2++5O2↑+8H2O
10Na++2Mn2++5O2↑+8H2O
16.将质量比等于式量比的Na、Na2O、Na2O2、NaOH,分别投入等质量的足量水中,所得溶液质量分数最大的是( )
A.Na B.Na2O
C.Na2O2 D.NaOH
17.在某碱性溶液中可以大量共存的离子组是( )
A.Na+、CO32-、K+、NO3-
B.Na2+、K+、Cl-、NO3-
C.Mg2+、K+、SO42-、Cl-
D.Ba2+、Na+、SO32-、Cl-
18.金属钠与其在空气中燃烧产物x分别加入到足量水中,生成的两种气体在一定条件下恰好完全反应,则与水反应的金属钠与被氧化成x的金属钠的质量比( )
A.1:1 B.2:1
C.23:78 D.46:78
19.下列反应中,一种物质既作氧化剂,又作还原剂的是( )
A.2Na+2H2O![]() 2NaOH+H2↑
2NaOH+H2↑
B.2H2O![]() 2H2↑+O2↑
2H2↑+O2↑
C.2Na2O2+2H2O![]() 4NaOH+O2↑
4NaOH+O2↑
D.2F2+2H2O![]() 4HF+O2↑
4HF+O2↑
20.下列物质混合后溶液中溶质的质量分数最大的是( )
A.4.6g钠投入45.4g水中
B.6.2g氧化钠投入42.2g水中
C.7.8g过氧化钠投入42.2g水中
D.8g烧碱投入42g水中
二、填空题
21.Na2O是
色固体,与水反应的化学方程式为
,制取Na2O通常采用的方法是2NaNO2+6Na![]() 4Na2O+N2↑,不采用钠在氧气中燃烧而采用此法是因为
。
4Na2O+N2↑,不采用钠在氧气中燃烧而采用此法是因为
。
22.填写出有关物质的化学式
(1)医药上用作缓泻剂的是
(2)可用来漂白织物、麦杆、羽毛的是
(3)用于制电光源的是
(4)用作原子反应堆导热剂的是
(5)用于玻璃、制皂、造纸、纺织等工业上的是
(6)用于焙制糕点的发酵粉及治疗胃酸过多的药剂的是
23.如果不慎将浓NaOH溶液洒在皮肤上,应马上
24.氢氧化钠又称 、 或 ,它极易溶于水,且 ,在空气中易吸收水蒸气,而发生 ,因此,氢氧化钠可作为一些气体的 ,对它必须 保存,且瓶塞要用 。
25.将CO2通入饱和Na2CO3溶液中,会发生 现象,这说明 ,有关反应的离子方程式为 。
三、推断题
26.A、B、C、D、E五种物质都含1~18号元素中的某一元素,它们按图所示关系相互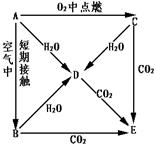 转化,已知A为单质。
转化,已知A为单质。
(1)写出A→E的化学式:
A B
C D
E
(2)写出A→D、C→D、C→E反应的化学方程式
A→D
C→D
C→E
四、计算题
27.将7.8gNa2O2投入到100g10%的苛性钠溶液中充分反应。求:
(1)所得溶液的质量分数
(2)向该溶液中通入一定量CO2,然后小心蒸干,所得固体冷却干燥,称重为58.8g,通过计算推出该固体物体的组成和质量。
28.加热一定量的小苏打充分反应后,称量剩余物A发现比原来少了3.1g。若加热同质量的小苏打及一定量的Na2CO3·xH2O的混合物,充分反应后,称量乘余物B,发现比原来减少12.1g。又知剩余物的质量比是B:A=2:1。求x的值。
参考答案
一、1.C 2.CD 3.CD 4.C 5.B 6.AC 7.D 8.AD 9.A 10.A 11.B 12.B 13.CD 14.B 15.B 16.BC 17.AB 18.A 19.BC 20.BC
二、21.白,Na2O+H2O![]() 2NaOH在空气中燃烧易被氧化成Na2O2,而在N2中不会
2NaOH在空气中燃烧易被氧化成Na2O2,而在N2中不会
22.(1)Na2SO4·10H2O (2)Na2O2 (3)Na (4)NaK合金 (5)Na2CO3 (6)NaHCO3 23.用大量水冲洗 24.略 25.白色沉淀,NaHCO3比Na2CO3溶解度小
2Na++CO2+H2O+CO32-![]() 2NaHCO3
2NaHCO3
三、26.(1)Na、Na2O、Na2O2、NaOH、Na2CO3,(2)2Na+H2O![]() 2NaOH+H2↑,2Na2O2+2H2O
2NaOH+H2↑,2Na2O2+2H2O![]() 4NaOH+O2↑,2Na2O2+2CO2
4NaOH+O2↑,2Na2O2+2CO2![]() 2Na2CO3+O2↑
2Na2CO3+O2↑
四、27.(1)17% (2)NaHCO3 12.6g Na2CO3 15.9g 28.x=10