高一级化学
![]()
![]()
![]() 上期期末考试题
上期期末考试题
化学(理科实验班)
命题:祝毅宏 校对:杨晓冬
考试时间:90分钟。分值:100分。
第一卷 (45分)
一:选择题(每题3分、共45分,每题只有一个正确选项符合题意)
1、用pH试纸测定某无色溶液的pH值时,规范的操作是:( )
A 将pH试纸放入溶液中观察其颜色变化,跟标准比色卡比较
B 将溶液倒在pH试纸上,跟标准比色卡比较
C 用干燥的洁净玻璃棒蘸取溶液,滴在pH试纸上跟标准比色卡比较
D 在试管内放入少量溶液,煮沸,把pH试纸放在管口,观察颜色,跟标准比色卡比较
![]()
![]() 2、在平衡体系中,H2S H++HS-,HS- H++ S2-中,增大溶液的pH,则c(S2-):(
)
2、在平衡体系中,H2S H++HS-,HS- H++ S2-中,增大溶液的pH,则c(S2-):(
)
A 增大 B 不变 C 减小 D 可能增大可能减小
3、100mL0.1mol/L醋酸与50mL0.2mol/L氢氧化钠溶液混合,在所得溶液中 ( )
A c(Na+) >c(CH3COO-)>c(OH-)> c(H+)
B c(Na+) >c(CH3COO-)>c(H+)> c(OH-)
C c(Na+) >c(CH3COO-)>c(OH-)= c(H+)
D c(Na+) =c(CH3COO-)>c(OH-)> c(H+)
4、把0.05molNaOH固体分别加入下列100mL液体中,溶液的导电性基本不变的是:( )
A 自来水 B 0.5mol·L-1的盐酸
C 0.5mol·L-1的醋酸 D 0.5mol·L-1的氨水
5、在蒸发皿中加热蒸干并灼烧(低于400℃)下列物质的溶液,可以得到该物质固体的是( )
A 氯化铝 B 碳酸氢钠 C 醋酸钠 D 硫酸铝
6、pH相同的醋酸溶液和盐酸分别用蒸馏水稀释至原体积的m倍和n倍,稀释后两溶液pH仍相同,则m、n的关系是:( )
A m=n B m>n C m<n D 无法判断
7.物质的量浓度相同的下列溶液中,含离子种类最多的是
A CaCl2 B CH3COONa C NH3 D K2S
8.等物质的量浓度的下列溶液中,NH4+离子的浓度最大的是
A. NH4Cl B .NH4HCO3 C. NH4HSO4 D. NH4NO3
9.某温度下,在一容积可变的容器中,反应2A(g)+B(g)![]() 2C(g)达到平衡时,A、B和C的物质的量分别为4mol、2mol和4mol。保持温度和压强不变,对平衡混合物中三者的物质的量做如下调整,可使平衡右移的是( )
2C(g)达到平衡时,A、B和C的物质的量分别为4mol、2mol和4mol。保持温度和压强不变,对平衡混合物中三者的物质的量做如下调整,可使平衡右移的是( )
A 均减半 B 均加倍 C 均增加1mol D 均减少1mol
10.近年来,冠以“绿色”的新概念不断产生,如绿色食品、绿色材料、绿色能源、绿色化学等,这里的“绿色”是对人类社会可持续发展战略的形象表述。“绿色化学”要求从经济、环保和技术上设计可行的化学反应。据此,由单质镁制硝酸镁的下列4个方案中,你认为可行而且符合“绿色化学”要求的方案是( )
A.![]()
B.![]()
O2 稀HNO3
![]()
![]() C.Mg
MgO
Mg(NO3)2
C.Mg
MgO
Mg(NO3)2
D.![]()
11.室温下,某溶液中由水电离出来的H+和OH-物质的量浓度的乘积为10-24,在该溶液中,一定不能大量存在的离子是( )
A.HCO3- B.SO32- C.NH4+ D.NO3-
12.将25mL碱式滴定管中的NaOH溶液(浓度为0.1mol/L,液面处于20.0mL处)
全部放入锥形瓶中,滴入甲基橙,用酸式滴定管向瓶中滴入0.1mol/L的稀盐酸到终点,耗去盐酸的体积和终点时的颜色分别为( )
A.20.0mL,橙色 B.5.0mL,橙色
C.20.0mL ,红色 D.大于5.0 mL,橙色
13.一定条件下将2mol SO2和2mol SO3气体混合于一固定容积的密闭容器中,发生反应:2SO2+O2
![]() 2SO3,平衡时SO3为n mol,在相同温度下,分别按下列配比在上述容器中放入起始物质,平衡时SO3的物质的量可能大于n的是( )
2SO3,平衡时SO3为n mol,在相同温度下,分别按下列配比在上述容器中放入起始物质,平衡时SO3的物质的量可能大于n的是( )
A.2 mol SO2 + 1 mol O2
B.4 mol SO2 + 1 mol O2
C.2 mol SO2 + 1 mol O2 + 2 mol SO3
D.2 mol SO2 + 0.5 mol O2 + 1 mol SO3
14、用铁酸钠(Na2FeO4)对来自河湖的淡水消毒是城市饮用水处理新技术,下列对Na2FeO4用于饮用水消毒处理的分析正确的是( )
A.Na2FeO4在溶液中显强碱性,能消毒杀菌
B.Na2FeO4的还原产物是Fe3+,易水解生成Fe(OH)3,可使水中悬浮物凝聚沉降
C.Na2FeO4的还原产物是Fe2+,易水解为Fe(OH)2,可使水中悬浮物凝聚沉降
D.Na2FeO4中Fe为+6价,具有强氧化性,能消毒杀菌
15、下列有关反应的离子方程式正确的是 ( )
A.硫化亚铁中加入盐酸:S2-+2H+=H2S↑
B.酸性硫酸亚铁中加入H2O2:Fe2++2H2O2+4H+=Fe3++4H2O
C.二氧化碳通入2mol/L碳酸钠溶液中: CO2+CO32-+H2O===2HCO3-
D.过量硫酸滴入偏铝酸钠溶液中:H++AlO2-+H2O===Al(OH)3↓
第一卷答案:
| 0 | 1 | 2 | 3 | 4 | 5 | 6 | 7 | 8 | 9 | |
| 0 | ||||||||||
| 1 |
第二卷 (55分)
二:填空(共35分)
16:(8分)在纯碱溶液中:
(1)滴入酚酞,有何现象 ,再将所得溶液进行加热又有何现象 。解释发生上述现象的原因
。
(2)试列出该溶液中所有离子的浓度大小顺序 。
 17.(4分)关于图1装置中的叙述正确的是( )。
17.(4分)关于图1装置中的叙述正确的是( )。
A 这是电解NaOH溶液的装置
B 这是一个原电池装置
 C Pt为正极,其电极反应为:2H++2e=H2↑
C Pt为正极,其电极反应为:2H++2e=H2↑
D Fe为负极,其电极反应为:4OH--4e=2H2O+O2↑
18.(12分)在100 mL 2 mol·L-1稀硫酸中加入0.1 mol的镁铝混合物,然后再滴加1 mol·L-1的NaOH溶液。请回答:
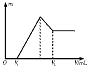
(1)若在滴加NaOH溶液过程中,沉淀质量m随加入NaOH溶液的体积V变化如图所示。当V1=160 mL时,金属粉末中n(Mg)= mol,V2= mL。
|
(3)若混合物仍为0.1 mol,其中Mg粉的物质的量分数为a,用100 mL 2 mol·L-1的硫酸溶解此混合物后,再加入450 mL 1 mol·L-1的NaOH溶液,所得沉淀中无Al(OH)3。满足此条件的a的取值范围是 。
19.(14分)某学生为了测定醋酸溶液中醋酸的含量,进行了如下实验:
①准确称取12.00g NaOH固体,配制1000mL溶液。
②取10mL 醋酸溶液,用第一步配得的NaOH溶液进行滴定。用去NaOH溶液19.90mL。
③重复上述滴定一次,此次用去NaOH溶液20.10mL。
(1) 在称样时,若称重前天平的指针偏向于标尺的右方,且把砝码和被称量物质的位置放反;而称量读数时,指针刚好在标尺的零点上。那么所得样品的质量是__________(填编号:A、大于12g;B、小于12g;C、恰好等于12g;D、不能确定。)
(2) 配制NaOH溶液所用的主要玻璃仪器中除了玻璃棒、滴管外,还需要_____________;滴定时应选用的指示剂是:____________。
(3)下列有关滴定的操作:①用标准液润洗滴定管;②往滴定管内注入标准溶液;③检查滴定管是否漏水;④滴定;⑤滴加指示剂于待测液;⑥洗涤。正确的操作顺序是
A.⑥③①②⑤④ B.⑤①②⑥④③
C.⑤④③②①⑥ D.③①②④⑤⑥
(4)下列操作会使结果偏高的是( )
(a).碱式滴定管用蒸馏水洗净后,即注入标准NaOH溶液。
(b).用酸式滴定管取用待测酸液前,尖嘴部分有气泡,取用过程中气泡消失。
(c).滴定前,读碱液体积时仰视;滴定后,读碱液体积时俯视。
(d).NaOH溶液露置时间太长。
(5)由以上数据,计算醋酸溶液中醋酸的质量分数还缺什么物理量:__________。(请注明单位)。
20、(9分)据下列信息完成所需回答的问题:
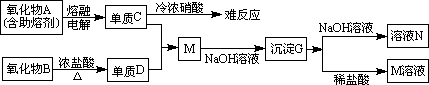
(1)、A是__________,D是___________,G是____________(填化学式)。
(2)、元素C位于周期表中第________周期________族。
(3)、写出下列反应的离子方程式。
B+浓盐酸______________________________
G+NaOH溶液______________________________
(4)、单质C不与冷浓硝酸反应的原因是_______________。
(5)、已知一定质量的B与足量的浓盐酸反应生成的D在标准状况下的体积为5.6L,求被氧化的HCl的物质的量。(写出计算过程)
三.计算题(共8分)
21.有一种化学式为R(NO3)x·nH2O的硝酸盐晶体,现取此晶体6.05g溶于水配成500ml溶液,用石墨棒作为电极材料,对此溶液进行电解,当转移电子0.05mol后,溶液中的金属离子已全部放电,且其中一极增重1.60g(已知此晶体的摩尔质量为242g/mol),试求:
(1)R(NO3)x·nH2O中x和n的值以及R的原子量。
(2)设电解前后溶液的体积不变,则电解完成后溶液的pH是多少?