高中一年级化学下学期月考试题
化 学 试 卷
(考试时间90分钟,满分100分)
本试卷分为试题卷和答题卷两部分,其中试题卷由第I卷(选择题)和第II卷(非选择题)组成,题卷共4页;答题卷共1页;选做题共1页。考试结束后将答题卡和答题卷一并交回。
可能用到的相对原子质量:H-
第I卷 (选择题 共44分)
注意事项:
1.答第I卷前,考生务必将自己的姓名、考号、考试科目用铅笔准确涂写在答题卡上。
2.每小题选出答案后,用铅笔把答题卡上对应题目的答案标号涂黑,如需改动,用橡皮擦干净后再选涂其它答案,不能答在试题卷上。
一、选择题(本题包括22小题,每小题2分,共44分。每个小题只有一个选项符合题意。)
1、人类探测月球发现,在月球的土壤中含有较丰富的质量数为3的氦,它可以作为未来核聚变的重要原料之一。氦的这种同位素表示为:
A、4 3He B、3 2He C、2 4He D、3 3He
2、下列物质中,既含有离子键,又含有非极性共价键的是
A、Na2O2 B、NaOH C、CaCl2 D、H2O2
3、某主族元素R的最高正价与最低负价的代数和为4,由此可以判断
A、R一定是第四周期元素
B、R一定是IIA族元素
C、R的气态氢化物比同周期其他元素气态氢化物稳定
D、R的气态氢化物化学式为H2R
4、某元素的一种同位素可以用符号 ![]() X 表示, 则该原子的中子数为
X 表示, 则该原子的中子数为
A、Z B、A C、A–Z D、A + Z
5、A和B为短周期元素, A— 和 B2+ 具有相同的电子层结构, 下列比较中正确的是
A、原子半径 A > B B、离子半径 A— > B2+
C、原子的中子数 A > B D、原子序数 A > B
6、下列叙述中正确的是
A、两种粒子, 若核外电子排布完全相同, 则其化学性质完全相同
B、因为甲烷分子中碳氢键是极性键,所以甲烷为极性分子
C、两个原子, 如果核外电子排布相同, 则一定属于同种元素
D、阴离子的核外电子排布一定与上一周期稀有气体元素原子的核外电子排布相同
7、在下列单质中,属于半导体的是
A、O2 B、S C、Se D、Te
8、下列叙述中正确的是
A、离子化合物中不一定含有金属元素
B、同周期元素的原子半径越小, 越容易失去电子
C、同周期非金属元素的原子半径越小, 气态氢化物的稳定性越弱
D、离子化合物都属于强电解质, 一定都易溶解于水
9、下列有关离子方程式的书写中正确的是
A、硫酸铜溶液中加入氢氧化钠:Cu2+
+ NaOH = Cu(OH)2![]() +Na+
+Na+
B、将氢氧化铝溶解于盐酸溶液中: OH— + H+ = H2O
C、金属钠与水反应: Na + 2 H2O
= Na+ + 2 OH— + H2![]()
D、将氧化铝溶解于氢氧化钠溶液中: Al2O3 + 2 OH— = 2 AlO2— + H2O
10、主族元素在周期表中的位置取决于该元素原子的
A、相对原子质量和核外电子数 B、相对原子质量和最外层电子数
C、电子层数和最外层电子数 D、电子层数和次外层电子数
11、下列说法中正确的是
A、离子化合物中一定不含共价键 B、共价化合物中一定不含离子键
C、仅含有非金属元素的物质一定是共价化合物
D、元素周期表中, 第三周期元素的原子半径最小的是钠原子
12、电子总数不相等的两种分子是
A、 NH3和CH4 B、CO2和N
13、对不同元素的原子,叙述正确的是
A、质子数一定相等 B、质子数一定不相等
C、中子数一定不相等 D、电子数一定相等
14、运用元素周期表和元素周期律, 下列推断中不正确的是
A、砹是一种有色固体, 它的气态氢化物很不稳定
B、在周期表中金属和非金属元素的分界线附近可以寻找制取新农药的元素
C、铷的硫酸盐易溶解于水, 其氢氧化物一定是强碱
D、溴化氢没有氯化氢稳定
15、已知元素X、Y的核电荷数分别为a和b,它们的离子Xm+和Yn-的核外电子排布相同,则下列关系式正确的是
A、a=b+m+n B、a=b+m-n C、a=b-m+n D、a=b-m-n
16、下列各组物质中,属于同素异形体的是
A、H2O和D2O B、35Cl和37Cl C、C60和金刚石 D、镁条和镁粉
17、下列非金属元素中,在自然界中能以游离态存在的是
A、硫 B、氯 C、氟 D、钠
18、硒为第四周期VIA族元素,根据它在周期表中的位置推断,硒不可能具有的性质为:
A、在通常状况下是固体 B、SeO3的水化物为酸
C、H2Se比H2S稳定 D、硒元素有+4、+6、-2三种常见化合价
19、A、B、C、D、E是同一周期的五种主族元素,A和B的最高价氧化物对应的水化物均呈碱性,且碱性B>A,C和D的气态氢化物的稳定性C>D;E是这五种元素中原子半径最小的元素,则它们的原子序数由小到大的顺序是
A. A、B、C、D、E B. E、C、D、B、A
C. B、A、D、C、E D. C、D、A、B、E
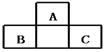 20、A、B、C均为短周期元素,它们在周期表中的位置如图,已知B、C两元素在周期表中族序数之和是A元素族序数的2倍;B、C元素的原子序数之和是A元素原子序数的4倍,则A、B、C 所在的一组是
20、A、B、C均为短周期元素,它们在周期表中的位置如图,已知B、C两元素在周期表中族序数之和是A元素族序数的2倍;B、C元素的原子序数之和是A元素原子序数的4倍,则A、B、C 所在的一组是
A. Be、Na、Al B. B、Mg、Si
C. O、P、Cl D. C、Al、P
21、下列分子中具有极性键的非极性分子是
A、H2 B、HCl C、H2O D、CO2
22、下列变化规律中正确的是
A、Na、Mg、Al的原子半径依次增大 B、C、Si、S的非金属性依次增强
C、H2S、HCl、PH3的热稳定性依次增强 D、H4SiO4、H3PO4、H2SO4的酸性依次增强
第II卷 (非选择题 共56分)
23、(4分)从原子结构的观点分析, 元素周期表中同一横行的短周期元素, 其___________相同, __________ 不同, 同一纵行的主族元素, 其 ______________相同, ____________不同。
24、(23分)下表列出了a—r九种元素在周期表中的位置:
|
周期 | IA | IIA | IIIA | IVA | VA | VIA | VIIA | O |
| 二 | e | f | ||||||
| 三 | a | c | d | g | r | |||
| 四 | b | h |
回答下列问题:(除第(1)题外,其余各小题每空2分)
(1) 这九种元素分别为(填元素符号,每三格一分,共3分)
| a | b | c | d | e | f | g | h | r |
(2)a、b、c三种元素按原子半径由大到小的顺序排列为 ;(填元素符号)
(3)a、c 、d三种元素的氧化物对应的水化物碱性最强的是 ;(填化学式)
(4)f元素氢化物的化学式为 ,该氢化物在常温下跟b发生反应的化学方程式为 ;
(5)g元素跟a元素形成化合物的化学式为 ,高温灼烧该化合物时,火焰呈 色;
(6)e元素和f元素形成的化合物电子式为 ;
(7)d元素原子结构示意图为 ,它的最高价氧化物对应水化物化学式为 ,写出它与NaOH溶液反应的离子方程式为
25、(4分)质量数为A,质子数为Z的X原子,其符号为 ,一种氢原子,它的原子核内有一个质子而没有中子,则它的构成符号为 ,另一种氢原子,它的原子核内有一个质子和一个中子,则它的构成符号为 ,第三种氢原子,它的原子核内有一个质子和两个中子,则它的构成符号为
26、 (6分)有A、B、C、D四种短周期元素, 它们的原子序数由A到D依次增大, 已知A和B原子有相同的电子层数, A、B可形成AB2型共价化合物,且A的L层电子数是K层电子数的两倍, C燃烧时呈现黄色火焰, C的单质在高温下与B的单质充分反应, 可以得到与D单质颜色相同的淡黄色固态化合物,B、D在周期表中同主族。请回答:
(1)写出C2B2 的电子式为 ______________
(2)画出D的原子结构示意图 , 用电子式表示化合物 C2D 的形成过程
27、(8分)在35Cl中含有 个质子, 个中子, 个电子,它的质量数为 。氯在周期表中位于 周期 族,它的最高价氧化物的水化物的化学式为 ,气态氢化物的化学式为
28、(5分)在常温、常压下,臭氧是一种________色有 味的_______体。它的密度比氧气的_______,比氧气______溶于水。
29、计算(6分)同一周期左右相邻的A、B、C三种短周期元素,A的最高价氧化物的化学式为A2O,
(1)B的相对原子质量是多少?原子序数是多少?
(2)A和C各是什么元素?并指出它们在周期表中的位置。
高一下期第一次月考化学答题卷
班: 姓名:
23、(4分) ___________相同, __________ 不同, ______________相同, ____________不同。
24、(23分) 回答下列问题:(除第(1)题外,其余各小题每空2分)
(1)这九种元素分别为(填元素符号,每三格一分,共3分)
| a | b | c | d | e | f | g | h | r |
(2) ; (3) ;
(4) , ;
(5) , ; (6) ;
(7) , ,
25、(4分) ; ; ;
26、 (6分)
(1)______________
(2) ,
27、(8分) , , , 。 , , ,
28、(5分) 、 、 。 , 。
29、计算(6分)
选做题(不计入总分)
1、同一主族的X、Y、Z三种元素,已知最高价氧化物对应水化物的酸性强弱是
H3XO4<H3YO4<H3ZO4,下列推断正确的是( )
A.元素的非金属性强弱:X>Y>Z B.气态氢化物稳定性:XH3<YH3<ZH3
C.原子半径:X<Y<Z D.水溶液的酸性:H3YO4<H3XO4<H3ZO4
2、某一周期ⅡA族元素的原子序数为x,则同周期的ⅢA族元素的原子序数 ( )
A.只有x+1 B.可能是x+8或x+18
C.可能是x+2 D.可能是x+1或x+11或x+25
3、下列叙述中正确的是 ( )
A、阳离子一定是金属离子, 阴离子一定只含有非金属元素
B、某金属元素的阳离子和某非金属元素的阴离子组成的物质一定是纯净物
C、质量数相同的原子,它们一定具有相同的质子数
D、金属钾(K)不可能从盐的水溶液中置换出金属单质
4、A、B、C三种元素的原子核外电子数都比氩原子少, 若A和C处于同一主族, A和B的核电荷数之差为 5 , B原子的M电子层比L电子层少两个电子, 则A、B、C三种元素分别为
A、 Li、Na、S B、Na、S、Li C、Na、K、Br D、K、Br、Na
5、 (1) X和Y两种元素形成XY2型化合物, XY2中有 38 个电子, 若XY2为离子化合物, 则其电子式为 ___________ , 若XY2 为共价化合物, 则其电子式为 ___________ .
(2)由两个原子核和 10个电子的阴离子的电子式为 _______________.
(3)由5 个原子核和10 个电子构成的分子的电子式为 _________________.
(4) A元素原子L层比B元素原子L层少3 个电子, B元素原子核外电子总数比A元素原子核外电子总数多5个, 则A和B两元素形成的化合物可以表示为 _____________ .
6、过氧化氢(H2O2)俗名双氧水,医疗上用作外科消毒剂。
⑴向含有酚酞的NaOH溶液中滴加双氧水,溶液由红色褪至无色,主要原因是双氧水具有 性。
⑵将双氧水加入经酸化的高锰酸钾溶液中,溶液的紫红色消褪了,此时双氧水表现出 性。
7、某主族元素A和B, 它们各自形成稳定的简单离子的电子层相差两层, 已知A处于m 族, B 处于n 族, 且B的单质是通过共价键结合的. 则:
(1)若A和B位于二和三周期, 则A的质子数为 _________ , B的质子数为 ________.
(2)若A和B位于三和四周期, 则A的质子数为 _________ , B的质子数为 ________.
8、X、Y、Z、W是周期表中1~20号的元素,已知0.1mol X单质与足量水反应,在标准状况下生成氢气1120mL,而位于X下一周期的Z元素,其单质与X单质物质的量相同时,跟水反应生成氢气的量是X单质生成氢气量的2倍;X单质可在Y单质里燃烧,生成淡黄色的X2Y2化合物,W与氢的化合物WH4是一种无色气体,其在空气中完全燃烧生成的两种产物都能与化合物X2Y2反应,同时都有Y单质生成。
(1)分析并推断出X、Y、Z、W各是什么元素?
(2)写出WH4燃烧的两种产物分别与X2Y2反应的化学方程式。