
![]() 龙泉中学2004春高一年化学期中考试卷2004-3-25
龙泉中学2004春高一年化学期中考试卷2004-3-25
(满分:100分 时间:90分钟)
可能用到的原子量:O:16 P:31 H:1 He:20
第Ⅰ部分: 选择题(共40分)
一选择题(每小题只有一个选项符合题意,每小题2分,共40分)
1.质子数和电子数均相同的有 ( )
A.CH4、H2O、Na+ B. F2、Ar、HCl
C.H3O+、NH4+、Na D.O2-、Mg2+、Ne
2.同温同压下,相同物质的量的氢气和氦气,具有相同的
( )
A 原子数 B 质子数 C 密度 D 质量
3.元素的化学性质主要取决于原子的( )
A.原子序数 B.核外电子数
C.最外层电子数 D.核内中子数
4.下列各分子中所有原子都满足最外层为8电子结构的是( )
A.BeCl2 B.PCl3 C.PCl5 D.H2
5.X、Y、Z是三种主族元素,若X的阳离子与Y的阴离子具有相同的电子层结构,Z的阴离子半径小于等电荷的Y的阴离子半径,则三种元素的原子序数的大小顺序是( )
A.Z>Y>X B.Z>X>Y C.X>Y>Z D.X>Z>Y
6. 据报道,1994年12月科学家发现了一种新元素,它的原子核内有161个中子,质量数为272。该元素的原子序数为( )
A.111 B.161 C.272 D.433
7.同周期的A、B、C三元素,其最高价氧化物对应水化物的酸性强弱顺序是HAO4>H2BO4>H3CO4,则下列判断错误的是( )
A.原子半径A>B>C
B.气态氢化物稳定性HA>H2B>CH3
C.非金属性A>B>C
D.阴离子还原性C3->B2->A-
8.元素A、B、C原子核内质子数之和为31,最外层电子数之和为17,这三种元素是( )
A N、P、Cl B P、O、S C N、O、S D O、F、Cl
9.含有非极性键的离子化合物是( )
A.Na2O2 B.NaOH C.NH4Cl D.H2O2
10.第7周期为不完全周期,若将来的发现把这一周期元素全部填满,则下列有关第7周期元素的推论可能正确的是( )
A.第7周期排满时有32种元素,全部是放射性元素
B.第7周期排满时最后一种元素的单质不与任何物质发生化学反应
C.第7周期第ⅦA族元素的原子序数为117,是一种非金属元素
D.第7周期第ⅢA族元素的氢氧化物与Al(OH)3具有相似的化学性质
11.按微粒的半径从小到大的顺序排列的是( )
A.N、O、F B.K、Na、Li
C.Cl、S、P D.Mg、Al、Na
12.共价键的键能越大,说明( )
A.此共价键越牢固 B.此共价键的极性越强
C.此物质的熔点越高 D.此共价键的极性越弱
13.下列变化规律正确的是( )
A.Na、Mg、Ca的原子半径从大到小
B.HCl、PH3、H2S热稳定性从弱到强
C.Al、Ca、Cs还原性从强到弱
D.H3PO4、H2SO4、HClO4酸性从弱到强
14.下列各晶体熔化时只需要克服分子间作用力的是( )
A.SiC B.KCl C.SO2 D.NH4Br
15.某阳离子与Ar具有相同的电子层结构,阴离子与Ne具有相同的电子层结构,该阴、阳离子所形成的化合物可能是( )
A.K2S B.NaF C.CaF2 D.Na2O
16.含有元素硒(Se)的保健品现在已开始进入市场,已知它与氧同族,与钾同周期,则下列关于硒的叙述中不正确的是( )
A.原子序数为24
B.最高价氧化物的化学式为SeO3
C.非金属性比溴弱
D.气态氢化物的化学式为H2Se
17.下列离子化合物中,阴离子与阳离子的半径比最大的是( )
A.CsI B.LiI C.CsF D.LiF
18.能证明铝的金属性比镁弱的实验事实是( )
A.铝的原子半径比镁小
B.镁与浓硫酸反应,铝与冷的浓硫酸不反应
C.Al(OH)3能溶于NaOH溶液,而Mg(OH)2不能
D.铝的金属光泽不如镁显著
19.能以离子键相结合生成AB2型(B为阴离子)离子化合物,它们的原子序数分别为( )
A.11和17 B.12和16 C.20和9 D.13和17
20.铜在自然界有两种同位素,即63Cu、65Cu,铜的原子量是63.5,则63Cu和65Cu的原子个数比是( )
A.1:1 B.1:2 C.3:2 D.3:1
![]()
![]() 选择题答案:
选择题答案:
| 1 | 2 | 3 | 4 | 5 | 6 | 7 | 8 | 9 | 10 |
| 11 | 12 | 13 | 14 | 15 | 16 | 17 | 18 | 19 | 20 |
第Ⅱ部分:非选择题(共60分)
二、填空题(共50分)
21.10g重水中含有_____个中子。同物质的量的H2O、D2O、T2O三种水的质量比为______________。(4分)
22.用电子式表示:(6分)
(1)Br2分子的形成过程:_________________________________.
(2)H2S分子的形成过程:_________________________________.
(3)CO2分子的形成过程:_________________________________.
23.碘升华,微粒间克服了______作用。固体烧碱溶于水,扩散的微粒克服了______作用。(6分)
24.每个分子中有10个电子的氢化物有(写出三种分子)__________________________。每个离子中有10个电子的有(写出六种离子的符号)__________________________。(2+3分)
25.下表是元素周期表的一部分,回答下列问题:(22分)
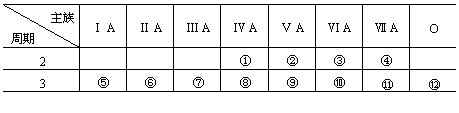
(1)写出①、②两种元素的名称_______。
(2)写出⑧、⑨两元素的符号_______。
(3)在这些元素中_______是最活泼的金属元素;_______是最活泼的非金属元素;______是最不活泼的元素。(写元素符号)
(4)这些元素的最高价氧化物对应的水化物中_______酸性最强;______碱性最强;能形成两性氢氧化物的元素是_____。
(5)从⑤到 ![]() 元素中_______原子半径最小。
元素中_______原子半径最小。
(6)⑤与⑥的化学性质,_______更活泼;怎样用实验证明(简述操作、现象和结论)______________________________________。
26.在周期表中还原性最强的一族元素是_______,它们的原子最外电子层上的电子数目是______,该族元素氧化物对应的水化合物的通式是______,这些化合物属于_______,该族元素随核电荷数的递增,原子半径逐渐_______,还原性逐渐______。写出该族第三周期元素的单质在空气中燃烧的化学方程式__________________。(7分)
三、计算题(共2小题,共4+6=10分)
27.A.、B同一短周期相邻主族的两种金属元素,且A在B的左边,它们的相对原子质量之比为8:9,A、B单质以3:2的物质的量之比混合成为1.28克粉末,与中量的盐酸完全反应后,在标况下生成1.344升氢气,通过计算确定A、B的名称,指出它们在周期表中的位置.
28.两单质AX和BY。已知1.55gA和0.8gBY的原子数相等,且它们的分子数之比为3∶4。又知A原子中的中子数比质子数多1,B原子的L层电子数是K层的3倍,计算写出AX、BY的化学式?