
![]() 高一级化学第一学期半期考试试题
高一级化学第一学期半期考试试题
化 学 试 题
本试卷由第I卷(选择题)和第Ⅱ卷组成,共4页;满分110分、考试时间90分钟。
提示:做题时请仔细审题,祝大家考出好成绩。选择题请答在第三页表格处。
![]() 相关元素相对原子量: Cl:35.5 H:1
O:16 Br:80 F:19 Na:23 N:14 Mn:55
相关元素相对原子量: Cl:35.5 H:1
O:16 Br:80 F:19 Na:23 N:14 Mn:55
第Ⅰ卷 选择题(共60分)
一、选择题(每小题只有一个正确选项,共18题,每小题3分,共54分)
 1.氧化还原反应的实质是
( )
1.氧化还原反应的实质是
( )
A. 分子中的原子重新组合 B. 氧元素的得失
C. 化合价的升降 D. 电子的得失或共用电子对的偏移
2.下列叙述中,正确的是 ( ) A.复分解反应一定都属于非氧化还原反应
B.在氧化还原反应中,非金属单质一定是氧化剂
C.某元素从化合态变为游离态时,该元素一定被还原
D.金属阳离子被还原一定得到金属单质
3.下列反应既是离子反应,又是氧化还原反应的是 ( )
A.氯化钠溶液中滴入硝酸银溶液 B.金属钠在氯气中燃烧
C.铁片置于硫酸铜溶液中 D.氢氧化钠溶液与稀硫酸反应
4.下列说法正确的是 ( )
![]() A、液态HCl、固体NaCl均不导电,所以HCl、NaCl均是非电解质
A、液态HCl、固体NaCl均不导电,所以HCl、NaCl均是非电解质
B、NH3、CO2的水溶液均导电,所以NH3、CO2均是电解质
C、铜、石墨均导电 ,所以它们均是电解质
D、蔗糖、酒精在水溶液或熔融状态下均不导电, 所以它们均是非电解质
5 关于反应C+CO2=2CO,下列说法正确的是 ( )
A. 是化合反应,不是氧化还原反应
B. CO既是氧化产物又是还原产物
C. 单质C中C的化合价升高,被还原,是氧化剂
D. CO2中C的化化合价降低,被氧化,CO2是还原剂
6.对反应2Na2O2+2CO2=2Na2CO3+ O2的正确说法 ( )
A.是置换反应 B.CO2是氧化剂
C.Na2O2既是氧化剂又是还原剂 D.氧化产物和还原产物都是O2
7.能大量共存且溶液是无色的离子组合是: ( )
A.H+、Na+、CO32-、MnO4- B.Cu2+、K+、NO3-、SO42-
C.K+、H+、NO3-、OH- D.Mg2+、Ca2+、Cl-、NO3-
8.下列变化中需加入氧化剂才能实现的是 ( )
A CuO→Cu B. Fe3+→Fe2+ C. . Cl-→Cl2 D. H2SO4→BaSO4
9.下列化学反应中,是吸热反应的是 ( )
A.铁粉与稀盐酸反应 B.硫酸与氢氧化钡溶液反应
C.甲烷在空气中燃烧 D.二氧化碳通过炽热的碳层
10.在2Na+2H2O=2NaOH+H2的反应中,生成0.2g氢气时,被氧化的金属钠的质量为: ( )
A:23g B:2.3g C:46g D:4.6g
11. 下列化学反应的离子方程式,不能只用Ba2++![]() =BaSO4↓表示的是
( )
=BaSO4↓表示的是
( )
A. 氯化钡溶液跟稀硫酸混合 B. 硝酸钡溶液跟稀硫酸混合
C. 氯化钡溶液跟硫酸溶液混合 D. 氢氧化钡溶液跟硫酸铜溶液混合
12.根据下列三个反应的化学方程式:I2 + SO2 + 2H2O === H2SO4 + 2HI,2FeCl2 + Cl2 === 2FeCl3,2FeCl3 + 2HI === 2FeCl2 + 2HCl + I2 , 有关物质的还原性依次减弱的顺序是:
( )
A.I-、Fe2+、Cl-、SO2 B.Cl-、Fe2+、SO2、I-
C.Fe2+、I-、Cl-、SO2 D.SO2、I-、Fe2+、Cl-
13.向酚酞试液中加入过量Na2O2粉末,振荡,下列叙述正确的是 ( )
A.溶液最后变成红色 B.溶液最后褪色
C.有气体生成 ,是H2 D.无明显现象
14.离子M2O7X-与S2-能在酸性溶液中发生如下反应:M2O7X- +3S2- +14H+==2M3+ +3Sœ +7H2O,则M2O7X-中M的化合价为 ( )
A.+4 B.+5 C.+6 D.+7
15.下列离子方程式中正确的是 ( )
A.用稀盐酸与大理石制CO2气体: 2H+ + CO32— == H2O + CO2↑
B.用醋酸溶解鸡蛋壳(CaCO3),得澄清溶液:
2CH3COOH + CaCO3 == 2CH3COO— + Ca2+ + H2O + CO2↑
C.用铜置换某废弃的AgNO3溶液中的银: Cu + Ag+ == Cu2+ + Ag
D.用铁和稀H2SO4制H2 : 2Fe + 6H+ == 2Fe3+ + 3H2↑
16.向Ba(OH)2溶液中滴入稀硫酸,则溶液的导电能力 ( )
A.逐渐变大 B.先变大后变小
C.先变小后变大 D.几乎不变
17.将4.6克金属钠投入足量水中,得到a克溶液,将4.8克镁投入到足量盐酸中(与水等质量),得到b克溶液,反应后两溶液质量关系是 ( )
A.a=b B.a>b C.a<b D.无法判断
18.过量的NaHCO3与Na2O2混合,在密闭容器中充分加热后,最后排除气体,残余物质是
( )
A.NaOH和Na2O2 B.NaHCO3和Na2CO3
C.Na2CO3 D.Na2O
 高一级化学第一学期半期考试试题
高一级化学第一学期半期考试试题
化 学 试 题
![]()
一、选择题(54分,每小题3分)
| 1 | 2 | 3 | 4 | 5 | 6 | 7 | 8 | 9 | 10 |
|
| |||||||||
| 11 | 12 | 13 | 14 | 15 | 16 | 17 | 18 | ||
|
|
二、填空题
19.(4分)燃料充分烧烧的条件有 和 。
20.(5分)在KClO3+6HCl(浓)==KCl+3Cl2↑+3H2O的反应中,氧化剂是 ;氧化产物是 ; 元素被氧化;得电子与失电子个数比是 ,氧化产物与还原产物的质量比是 。
21.(12分)现有以下物质:①KCl晶体 ②HCl气体 ③CaCO3固体 ④蔗糖 ⑤铝 ⑥SO3 ⑦NaOH固体
(1)以上物质中,能导电的是 (填写相应物质的序号,下同),溶于水能导电的是 ;
(2)以上物质中,属于电解质的是 ,属于非电解质的是 。
(3)以上物质中某些物质的水溶液能够与碳酸氢钠溶液发生离子反应,请写出这些反应的离子方程式:

![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]() 22.(10分)某化学研究性学习小组设计了如下图所示的实验装置。目的是做钠与水反应的实验并验证:①钠的物理性质;②钠与水反应的产物。请回答下列问题:
22.(10分)某化学研究性学习小组设计了如下图所示的实验装置。目的是做钠与水反应的实验并验证:①钠的物理性质;②钠与水反应的产物。请回答下列问题:
(1)实验开始时,欲使钠与水接触反应,应如何操作?
;
(2)反应开始后,试管中能观察到的实验现象是: (填写代号)
A.钠在水层中反应熔成小球并四处游动 B.钠在煤油的液面上反应并四处游动
C.钠停留在煤油层中不反应 D.钠在两液体界面处反应熔成小球并可能作上下跳动
(3)通过上述现象,能够验证钠的哪些物理性质: ;
(4)写出该反应的化学方程式,并标出电子转移的方向和数目。
23.(6分)有一包白色粉末状混合物,可能含有Na2CO3、NaCl、CaCO3、CuSO4、KCl、Na2SO4、MgCl2、KNO3中的一种或几种,现进行如下实验:
(1)将混合物溶于水,得到无色透明溶液。
(2)取少量上述溶液两份,其中一份加入BaCl2溶液,立即产生白色沉淀,再加入稀硝酸,沉淀不溶解,在另一份中加入NaOH溶液,也产生白色沉淀。
根据上述实验现象回答 ①原混合物中肯定没有_________ _
②原混合物中肯定有___________ _
③不能确定是否含有_________ ____
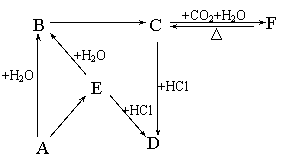 24.(9分)下图所示各项变化的未知数中均含有钠元素,E为淡黄色粉末,据此回答下列问题:
24.(9分)下图所示各项变化的未知数中均含有钠元素,E为淡黄色粉末,据此回答下列问题:
(1)写出物质的化学式:A: ;C: ;E:
(2)写出E→B的化学方程式: ;F→C: .
(3)在B→C的变化中所得C的溶液往往不纯,其中的杂质(不包括水)可能是 ,主要原因是 ;还可能是 ,主要原因是
![]() 三、计算题
三、计算题
25.(4分)已知实验室中制Cl2的有原理为:MnO2+4 HCl(浓)=MnCl2+2H2O+Cl2↑
问:如果现有44gMnO2至少需要含多少克HCl的浓盐酸才能将其反应完?其中有多少克HCl被氧化?
26.(6分)一块表面已被氧化成氧化钠的钠块质量为1.08克,投入到100 克水中完全反应后收集到0.02克氢气,求:
(1) 未被氧化的金属钠的质量是多少克?
(2) 所得溶液中溶质的质量分数是多少?
