高一化学第二学期三月份月考试题
高 一 化 学 试 卷
(物质结构 元素周期律) 命题人: 厉以农
本试卷分第Ⅰ卷(选择题)和第Ⅱ卷(非选择题)两部分
注意事项:将第Ⅰ、Ⅱ卷上每小题答案填写在答案纸对应题号的空格内。
第Ⅰ卷(共48分)
一、选择题(本题包括16小题,每小题3分,共48分,第1—6小题,每小题只有一个答案符合题意,第7—16小题,每小题有一个或两个选项符合题意)
1.下列各组物质中互为同位素的是( )
A.![]() 和
和![]() B.D和T
B.D和T![]() C.H2O和H2O2 D.O3和O2
C.H2O和H2O2 D.O3和O2
2.某元素原子的核外有三个电子层,最外层有4个电子,该原子核内的质子数为( )
A.14 B.15 C.16 D.17
3.下列气态氢化物按稳定性由强到弱顺序的是( )
A.HBr、HCl、HF B.HF、H2O、NH3
C.NH3、PH3、H2S D.SiH4、CH4、NH3
4.有一种保健食品含有人体所必须的硒元素,有一定的保健作用,已知硒元素与氧元素同族,与钙元素同周期,下列关于硒的描述不正确的是( )
A.原子序数是24 B.最高价氧化物是SeO3,是酸性氧化物
C.原子半径比钙小 D.气态氢化物化学式是H2Se,稳定性比HCl差
5.11g ![]() 所含的中子的物质的量为:( )
所含的中子的物质的量为:( )
A.4.5mol B.5mol C.5.5mol D.6mol
6.元素X、Y、Z的原子序数都小于18,X的阳离子,Y的阳离子和Z的阴离子都具有相同的电子层结构,Y的阳离子半径小于X的阳离子半径,则元素X、Y、Z的原子序数由小到大的顺序依次是( )
A.Z、Y、X B.Y、Z、X
C.Y、X、Z D.Z、X、Y
7.下列两核间距最小的离子化合物是( )
A.KCl B. NaF C. HF D. CaS
8.根据主族元素的原子序数不能确定的是:( )
A.质子数 B. 中子数 C. 价电子数 D. 相对原子质量
9.下列物质中,既可与盐酸反应,又可与氢氧化钠溶液反应的是( )
A.NaHSO4 B.NaHCO3 C.Al(OH)3 D.Na2SO3
10.与NH4+离子、质子总数和电子总数都相同的微粒是( )
A.Al3+ B.H3O+ C.OH― D.Na+
11.下列说法正确的是( )
A.难失去电子的原子,易形成阴离子
B.单质分子中不存在化学键,化合物的分子才存在化学键 ( )
C.离子化合物中一定含有离子键
D.离子化合物中一定含金属键
12.下列对铯及其化合物的预测正确的是( )
A.铯的熔点很高 B.在自然界中,铯能以游离态存在
C.氯化铯易溶于水 D.铯只有一种氧化物Cs2O
13.下列比较关系中,正确的是( )
A.元素金属性Na>Mg>Al B.热稳定性H2S<H2Se<HCl
C.酸性H3PO3<H2SO4<HClO4 D.原子半径Mg>Na>H
14.下列叙述正确的是( )
A.电子层数少的元素原子半径一定小于电子层数多的元素的原子半径
B.核外电子层结构相同的单核微粒半径相同
C.质子数相同的不同单核微粒,电子数越多,半径越大
D.原子序数越大,原子半径越大
15.阴离子![]() 含中子N个,X的质量数为A,则a gX的氢化物中含质子的物质的量是( )
含中子N个,X的质量数为A,则a gX的氢化物中含质子的物质的量是( )
A.![]() mol B.
mol B.![]() mol
mol
C.![]() mol
D.
mol
D.![]() mol
mol
16.下列化学键中,都属于极性共价键的是( )
A.共价化合物中的化学键
B.离子化合物中的共价键
C.同种元素原子间的共价键
D.不同元素原子间的共价键
第Ⅱ卷( 共 52 分)
二、填空题 (共36分)
17.(4分)H、D、T三种微粒,它们相互之间关系是 ,
同温同压下,它们单质的密度之比是 ,
在1mol单质中,它们的质子数之比是 ,
在相同状况下,1L单质中,它们的电子数之比是 。
18.(4分)用电子式表示下列各种微粒
NF CO2
KOH NH4+
19.(4分)离子化合物AB2,其中A为+2价离子,AB2的总质子数为54,A、B离子的核外电子排布相同,则A离子的结构示意图为 ,用电子式表示AB2的形成过程 。
20.(4分)下列分子结构:CO2、CH4、PCl5、Na2O2、MgF2,其中原子的最外层不能都满足8电子稳定结构的是 ,是离子化合物,且离子个数之比是2:1或1:2的是 。
21.(11分)短周期元素A、B、C、D中,0.5mol A元素的离子得到6.02×1023个电子被还原为中性原子,0.4g A的氧化物恰好与100ml 0.2mol/L的盐酸完全反应,A原子核内质子数目与中子数目相等,B元素原子核外M层电子数目比K层多1个,C―比A元素的离子多1个电子层,D元素的原子核外L层比K层多2个电子。
(1)A、B、C、D四种元素的名称分别是 、 、 、 。 (2)画出C―和D原子的结构示意图
(3)向B、C两种元素形成的化合物的水溶液里逐滴滴入苛性钠溶液,现象为______________________,写出有关离子方程式_________________________________;_________________________________。
22.(8分)元素A、B是周期表中处在同一主族,相邻周期的两种元素,A的原子序数为m,A、B所在周期包含的元素种类分别为x、y。
(1)如果A和B同在ⅡA,当B在A的上一周期时,B的原子序数为___________;当B在A的下一周期时,B的原子序数为___________;
(2)如果A和B同在ⅥA,当B在A的上一周期时,B的原子序数为___________;当B在A的下一周期时,B的原子序数为___________。
四、计算题(共16分)
23.(8分)9.6克A原子与4.2克B原子含有相同的原子数,A、B原子核中各自的质子数和中子数相等,已知A元素在其最高价氧化物中的质量分数为40%,在其氢化物中的质量分数为94.1%,试通过计算确定:
(1)A、B的元素符号及在元素周期表中的位置;
(2) A、B的相对原子质量。
24.(8分)已知Cl有两种天然同位素35Cl、37Cl,Cl的相对原子质量为35.5,Na只有一种原子23Na,求10吨纯度为90%的食盐(杂质中不含Na、Cl)样品中含37Cl多少吨,含Na35Cl多少吨?
高一化学参考答案
一、选择题(每小题3分,共48分)
1.B 2.A 3.B 4.A 5.D 6.D 7.B 8.BD 9.BC 10.BD
11.C 12. C 13.A、C 14.C 15.D 16. D
二、填空题(共36分)
17. 互为同位素;1:2:3;1:1:1;1:1:1 。 (每空1分,共4分)
18. 略 (每空1分,共4分)
19. 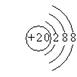 ; 略
; 略
20.PCl5、CH4、NaOH;Na2O2、MgF2
21. (1)镁、铝、氯、碳;(2) 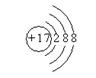 、
、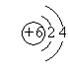 ;(3)Al3++3OH—===Al(OH)3↓;
;(3)Al3++3OH—===Al(OH)3↓;
Al(OH)3+OH—==AlO2—+2H2O
22.m-y;m+x;m-x;m+y
三、计算题(每题8分,共16分)
23. (1)A:S,第三周期第Ⅵ族;B:N,第二周期,第Ⅴ族
(2)A:32;B:14
24.![]() 6.6 t ;
6.6 t ;![]() =1.4 t
=1.4 t