高一化学调研试卷
本试卷分第Ⅰ卷(选择题)和第Ⅱ卷(非选择题)两部分, 共100分。考试时间90分钟。
可能用到的原子量:H 1 C 12 N 14 O 16 Na 23
Cl 35.5 Ca 40 Cu 64 Zn 65 S 32
第Ⅰ卷(选择题 共50分)
一、选择题(本题包括5小题,每小题2分,共10分。每小题只有一个选项符合题意。)
1.关于NO的下列叙述不正确的是
(A).NO可以是某些含低价N物质氧化的产物
(B).NO不是亚硝酸酐
(C).NO可以是某些含高价N物质还原的产物
(D).NO是红棕色气体
2.石墨炸弹爆炸时能在方圆几百米范围内撒下大量石墨纤维,造成输电线、电厂设备损坏。这是由于石墨
(A).有放射性 (B).易燃、易爆 C.能导电 (D).有剧毒
3.目前我国许多城市和地区定期公布空气质量报告,在空气质量报告中,一般不涉及
(A). SO2 (B). NO2 (C). CO2 (D). 可吸入颗粒物
4.你认为减少酸雨产生的途径可采取的措施是
①减少煤作燃料②造高工厂烟囱③燃料脱硫④在已酸化的土壤中加石灰⑤开发新能源
(A).①②③ (B).②③④⑤ (C).①③⑤ (D).①③④⑤
5.下列反应起了氮的固定作用的是
(A) .N2与H2在一定条件下反应生成NH3 (B) .NO与O2反应生成NO2
(C) .NH3 经催化氧化生成NO
(D) .由NH3制碳铵和硫铵
二.选择题(本题包括20小题,每小题2分,共40分。每小题只有一个选项符合题意。)
6.下列说法不正确的是
(A) .硫是一种淡黄色的不溶于水的固体
(B) .硫的化合物常存在于山火喷出的气体中和矿泉水里
(C) .硫与氧属于同一主族
(D).硫在空气中的燃烧产物是二氧化硫,在纯氧中的燃烧产物是三氧化硫
7.能正确表示下列反应的离子方程式是
(A) .硫化亚铁跟盐酸反应: FeS + 2H+ = Fe2+ + H2S↑
(B) .氯气跟水反应: Cl2 + H2O = 2 H+ + Cl- +
ClO-
(C) .钠跟水反应: Na + 2 H2O = Na+ +
2 OH- + H2↑
(D) .硫酸铜溶液跟氢氧化钡溶液反应: Ba2+ + SO42 - = BaSO4↓
8. 将等物质的量的镁和铝相混合,取等质量该混合物四份,分别加到足量的下列溶液中,充分反应后,放出氢气最多的是
(A) .3摩/升HCl (B) .4摩/升HNO3 (C) .12摩/升HNO3 (D) .18摩/升H2SO4
9.鉴别纯碱、石灰石、芒硝、石膏四种固体物质,应选用
(A).硝酸 (B). NaOH溶液 (C). 水 、 盐酸 (D). BaCl2和HN03
10. 某金属单质跟一定浓度的硝酸反应,假定只产生单一的还原产物.当参加反应的单质与被还原硝酸的物质的量之比为2:1时,还原产物是
(A) .NO2 (B) .NO (C) .N2O (D) .N2
11、实验室中不可用于制取NH3的有
(A ) 加热浓氨水 B)生石灰和浓氨水
(C).Ca(OH)2和NH4Cl共热 D)用氢气和氮气催化合成
12.在下列四种溶液中,分别加入少量固体二氧化锰,能产生气体的是
(A).3%H2O2溶液 (B).1摩/升NaOH溶液
(C).1摩/升KClO3溶液 (D).1摩/升盐酸
13.在体积为V升的密闭容器中通入a摩NO和b摩O2.反应后容器内氮原子数和氧原子数之比为
![]()
![]()
![]()
![]()
14.当今化学界关注的热点之一的C60, 下列说法正确的是:
(A) .C60是一种新型的化合物 (B) .C60和石墨都是碳的同位素
(C) .C60中含离子键 (D) .C60的相对分子质量是720
15.关于氮族元素(用R代表)的下列叙述正确的是
(A).最高化合价是+5价 (B).氢化物的通式为RH5
(C).非金属性由上到下递增 (D).其含氧酸均为一元强酸
16. 等体积硫酸铝、硫酸锌、硫酸钠溶液分别与足量的氯化钡溶液反应。若生成的硫酸钡沉淀的质量比为1︰2︰3,则三种硫酸盐溶液的物质的量浓度比为
(A). 1︰2︰3 (B). 1︰6︰9 (C). 1︰3︰3 (D). 1︰3︰6
17. 下列气体不能用浓 H2SO4干燥的是
(A).CO2 (B).H2S (C).SO2 (D).HCL
18. 0.05 mol某单质与0.8 g硫在一定条件下完全反应,该单质可能是
(A). H2 (B). O2 (C). K (D).Zn
19. 向 50 mL 18mol/ LH2SO4 溶液中加入足量的铜片并加热,充分反应后,被还原的H2SO4的物质的量是
(A) .等于0.45mol (B). 小于0.45mol
(C) .大于0.45mol (D). 在0.45mol和0.9mol之间
20.在一定温度和压强下,将装有氮气和二氧化氮混合气体的试管倒立在水中,经过足够时间后,试管内气体体积缩小为原体积的3/5,则原混合气体中氮气与二氧化氮的体积比是
(A) .2:3 (B) .3:2 (C) .3:5 (D) .5:3
21.下列各组离子在水溶液中能大量共存并且溶液为无色透明的离子组是
(A).K+、HCO3-、CO32-、Br- (B).CO32-、HCO3-、OH-、K+
(C).Fe3+、Cu2+、NO3-、SO42- (D).H+、Cl-、Na+、SO32-
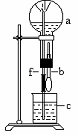 22.在下图装置中,烧瓶中充满干燥气体a,将滴管中的液体b挤入烧瓶内,轻轻振荡烧瓶,然后打开弹簧夹f,烧杯中的液体b呈喷泉状喷出,最终几乎充满烧瓶.则a和b分别是
22.在下图装置中,烧瓶中充满干燥气体a,将滴管中的液体b挤入烧瓶内,轻轻振荡烧瓶,然后打开弹簧夹f,烧杯中的液体b呈喷泉状喷出,最终几乎充满烧瓶.则a和b分别是
|
| a(干燥气体) | b(液体) |
| (A). | NO2 | 水 |
| (B). | CO2 | NaHCO3溶液 |
| (C). | Cl2 | 饱和NaCl溶液 |
| (D). | NH3 | 1摩/升盐酸 |
23、高岭土的组成表示为:![]() ,其中x,y的数值为
,其中x,y的数值为
(A) .7、2 (B) .5、4 (C) . 6、3 (D) .3、6
24.将足量CO2通人KOH和Ca(OH)2的混合稀溶液中,生成沉淀的物质的量(n)和通入CO2体积(V)的关系正确的是
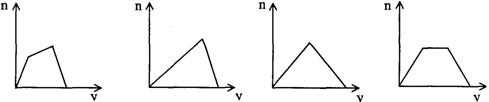
(A). (B). (C). (D).
25. 38.4 毫克铜跟适量的浓硝酸反应,铜全部作用后共收集到气体22.4 毫升(标准状况),反应消耗的HNO3的物质的量可能是
(A) .1.0×10-3摩尔 (B) .1.6×10-3摩尔
(C) .2.2×10-3摩尔 (D) .2.0×10-3摩尔
高一化学答题纸
|
| 一~二 | 三 | 四 | 五 | 总分 |
![]() 第Ⅰ卷答案栏
第Ⅰ卷答案栏
| 题号 | 1 | 2 | 3 | 4 | 5 | 6 | 7 | 8 | 9 | 10 | 11 | 12 | 13 |
| 答案 | |||||||||||||
| 题号 | 14 | 15 | 16 | 17 | 18 | 19 | 20 | 21 | 22 | 23 | 24 | 25 | |
|
|
第 Ⅱ 卷(非选择题,共50分)
| 得分 | 评卷人 |
三、实验题(共2小题,17分)
26.(5分) 向NaOH和酚酞的混合液中滴入双氧水,红色消失,
有的人认为是H2O2具有弱酸性,将NaOH溶液中和而使红色消失,有的人却认为是H2O2具有具有强氧化性,将有色物质氧化成无色物质而永久性褪色。
(1)、(3分)请设计一个简单的实验证明谁的观点正确:
(2)、(2分)含ClO- 的溶液和H2O2 发生激烈反应,产生能量较高的氧分子,它立即
转变为普通氧分子,向反应后的溶液中加入酸化的硝酸银溶液,有白色沉淀,则
ClO-与H2O2反应的离子方程式是 _____________________________________。
H2O2在反应中表现出 ____ 性。(填氧化或还原)
27.(12分)根据下图回答问题:
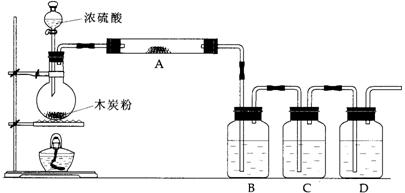
(1)上述装置中,在反应前用手掌紧贴烧瓶外壁检查装置的气密性,如观察不到明显
的现象,还可以用什么简单的方法证明该装置不漏气。
答:
(2)写出浓硫酸和木炭粉在加热条件下发生反应的化学方程式:
(3)如果用图中的装置检验上述反应的全部产物,写出下面标号所表示的仪器中应加入的试剂的名称及其作用:
A中加入的试剂是 ,作用是 。
B中加入的试剂是 ,作用是 。
C中加入的试剂是 ,作用是除尽 气体。
D中加入的试剂是 ,作用是 。
| 得分 | 评卷人 |
四、填空题(共4小题,共22分)
28. A、B、C、D、E按下图所示关系发生变化(在一定条件下):
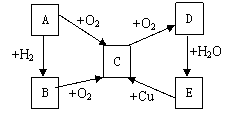 试回答:
试回答:
(1)若A是气体单质,则A为 B为
E为 (写化学式,下同)
(2)若A是固体单质,则A为 B为
E为
29. 红磷和白磷互称 。 .
在常温下,放置日久的纯净浓硝酸往往呈黄色,原因
是 . 该反应的化学方程式
是 _________________ 。浓硝酸使金属铝产生钝态是因为浓硝酸具有 性. 不用浓硝酸跟锌反应制取氢气是因为浓硝酸具有 性.
30.汽车尾气(含有CO、SO2与NO等物质)是城市空气的污染源。治理的方法之一是在汽车的排气管上装一个“催化转换器”(用铂、钯合金作催化剂)。它的特点是
使CO与NO反应,生成可参与大气生态环境循环的无毒气体,并促使尾气充分燃烧
及SO2的转化。
(1)写出一氧化碳与一氧化氮反应的化学方程式
(2)“催化转换器”的缺点是在一定程度上提高空气的酸度,其原因是
![]() ___________________________________________
___________________________________________
(3)控制城市空气污染源的方法可以有 (多选扣分)
a 开发氢能源 b 使用电动车 c 植树造林 d 戴上呼吸面具
![]()
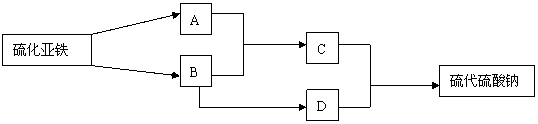
31. 已知硫粉跟亚硫酸钠溶液共热可制得硫代硫酸钠(Na2S2O3).现以硫化亚铁为主要原
料,按下图 制取硫代硫酸钠.图中的A、B、C和D是硫单质或硫的化合物,其它不含
硫的反应产物已被略去,各步反应可以添加必要的试剂 请填写下列空白:
 |
反应Ⅰ
反应Ⅲ
![]()
反应Ⅱ 反应Ⅴ
反应Ⅳ
(1) .反应(Ⅰ)的化学方程式是: ______________.
(2). 物质B的分子式是: _______________.
(3). 物质D的分子式: .
五、计算题(共2小题,11分)
32.(5分) 2.1 g Cu 跟足量的2.0 mol·L-1稀硝酸完全反应,计算
(1) 生成NO的体积(标准状况)。
(2) 反应消耗稀硝酸多少毫升?
33.(6分)在1.00L 1.00mol·L-1 NaOH 溶液中通入16.8 L标准状况下的CO2,
计算所得溶液中含有的NaHCO3和Na2CO3的物质的量。
(附加题,以下两题为实验班做,普通班不做)
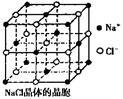 34.(3分)纳米材料的表面微粒占总微粒数的比例极大,这是纳米材料具有许多特殊性质的原因,假设某氯化钠纳米颗粒的大小和
34.(3分)纳米材料的表面微粒占总微粒数的比例极大,这是纳米材料具有许多特殊性质的原因,假设某氯化钠纳米颗粒的大小和
形状恰好与氯化钠晶胞的大小和形状(如图所示)相同,
则这种纳米颗粒的表面微粒数占总微粒数的百分数为
A.87.5% B.92.9%
C.96.3% D.100%
 35.(7分)随着科学技术的发展,阿伏加德罗常数的测定手段越来越多,测定的精确度也越来越高。现有一种简单可行的测定方法,具体步骤为:
35.(7分)随着科学技术的发展,阿伏加德罗常数的测定手段越来越多,测定的精确度也越来越高。现有一种简单可行的测定方法,具体步骤为:
(1)将固体NaCl细粒干燥后,准确称取mg NaCl固体并转移到
定容仪器A中;
(2)用滴定管向A仪器中加苯,不断振荡,继续加苯至A仪器
的刻度,计算出NaCl固体的体积V cm 3。
请回答下列问题:
①步骤(1)中A仪器最好使用____________(填序号)。
A.量简 B.烧杯 C.容量瓶 D.试管
②步骤(2)中用酸式滴定管还是用碱式滴定管____________,
理由是________________________________________________________________。
③能否用水代替苯____________,理由是________________________________。
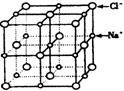
④
已知NaCl晶体中,靠得最近的![]() 与
与![]() 间的平均距离为a cm(如上图),用上述测定方法测得的阿伏加德罗常数
间的平均距离为a cm(如上图),用上述测定方法测得的阿伏加德罗常数![]() 的表达式为__________________________
的表达式为__________________________