高一(下)化学期末考试试题 A(卷)
一、选择题
1.食用下列物质不会引起中毒的是( )
A.用碳酸钡作X射线透视的“钡餐” B.加碘食盐
C.用甲醇兑制的白酒 D.用于混凝土防冻的亚硝酸钠
2.下列物质中,可用于治疗胃酸过多的是( )
A.氢氧化铝 B.碳酸钠
C.氧化钙 D.碳酸钡
3.制备某种气体,下列方法中可行的是( )
①NaHSO4固体与MnCl2固体混合共热制HCl ②FeS与稀硝酸混合制H2S ③浓H2SO4与K2SO3固体混合制SO2 ④强热氯化铵固体制取氨气
A.①② B.②④ C.①③ D.①②③④
4.常见的大气污染物分为一次污染物和二次污染物,二次污染物是排入环境的一次污染物在 物理化学因素或微生物作用下发生变化所生成的新污染物,如2NO+O2=2NO2,则NO2 为二次污染物,下列四种气体①SO2,②NO,③NO2,④Cl2中能导致二次污染的是( )
A.仅①②③ B.仅②④ C.仅② D.①②③④
5.已知aAn+、bB(n+1)+、cCn-、dD(n+1)-均具有相同的电子层结构,下列判断正确的是( )
A.元素金属性:B>A;元素非金属性:D>C
B.原子半径:A>B>C>D
C.离子半径:D(n+1)->Cn->B(n+1)+>An+
D.原子序数:b>a>c>d
6.X和Y属短周期元素,X原子的最外层电子数是次外层电子数的一半,Y位于X的前一周期,且最外层只有一个电子,则X和Y形成的化合物的化学式可表示为( )
A.XY B.XY2 C.XY3 D.X2Y3
7.根据稳定岛假说,元素周期表的最终界限可能在175号元素左右,科学家预测114号元素位 于第七周期ⅣA族,下列有关此元素的预测中,正确的是( )
A.其单质的硬度较小,熔点较低 B.它具有+2,+4价
C.其氢氧化物显强碱性 D.其离子比Cu2+离子的氧化性强
8.下列离子方程式,一定正确的是( )
A.硫化亚铁与稀硝酸反应FeS+2H+=Fe2++H2S
B.将标准状况下112 mL氢气通入10mL 1 mol/L的溴化亚铁溶液中:
2Fe2++4Br-+3Cl2=2Fe3++2Br2+6Cl-
C.向磷酸二氢钾溶夜中加入过量的氢氧化钡溶液
3Ba2++4OH-+2H2PO4-=Ba3(PO4)2![]() +4H2O
+4H2O
D.将少量SO2气体通入Ca(ClO)2溶液中
SO2+Ca2++2ClO-+H2O=CaSO3![]() +2HClO
+2HClO
![]()
![]() 9.已知硝酸铜受热分解的方程式为2Cu(NO3)2 2CuO+4NO2+O2,
某人将少量硝酸铜固体放入试管中加热使之分解后,将带火星的木条插入试管中,木条复燃 ,下列说法正确的是( )
9.已知硝酸铜受热分解的方程式为2Cu(NO3)2 2CuO+4NO2+O2,
某人将少量硝酸铜固体放入试管中加热使之分解后,将带火星的木条插入试管中,木条复燃 ,下列说法正确的是( )
A.木条复燃只是反应中生成了氧气
B.NO2不能支持燃烧
C.NO2能支持燃烧
D.木条复燃是反应中生成的NO2和O2与木条共同作用的结果
10.同主族元素形成的同一类型的化合物,往往结构和性质很相似,化合物PH4I是一种白 色晶体,有关对PH4I的叙述中不正确的是( )
A.是一种共价化合物 B.将其加热分解只得到无色气体
C.能跟NaOH溶液反应 D.可由PH3跟HI化合生成
11.用以下三种途径来制取等质量的硝酸铜
途径(1):铜跟浓硝酸反应
途径(2):铜跟稀硝酸反应
途径(3):铜先跟氧气反应生成氧化铜,氧化铜再跟硝酸反应
以下叙述正确的是( )
A.三种途径所消耗的铜的物质的量相等
B.三种途径所消耗的硝酸的物质的量相等
C.所消耗的铜的物质的量是:途径(3)>途径(1)>途径(2)
D.所消耗的硝酸的物质的量是:途径(1)>途径(2)>途径(3)
12.一包白色固体可能是下列化合物中的一种:NH4NO3、NaBr、NH4I、(NH4)2CO3,该固体易溶于水,生成的无色溶液分成两部分,取一部分加过量的NaOH溶液并微热, 产生一种使湿润红色石蕊试纸变蓝色的气体,另一部分加入氯水振荡后,溶液呈棕色,则原固体是( )
A.NH4NO3 B.NaBr C.NH4I D.(NH4)2CO3
| |
![]() ①2Na+2NH3 2NaNH2+H2↑
①2Na+2NH3 2NaNH2+H2↑
![]() ②CaO+2NH4Cl CaCl2+2NH3↑+H2O
②CaO+2NH4Cl CaCl2+2NH3↑+H2O
![]()
![]() ③2Mg(NH2)2 Mg3N2+4NH3↑
③2Mg(NH2)2 Mg3N2+4NH3↑
![]() ④NH4Cl+NaNH2 NaCl+2NH3↑
④NH4Cl+NaNH2 NaCl+2NH3↑
其中正确的是( )
A.全部正确 B.全部不正确 C.仅①正确 D.②③正确
14.硼有两种天然同位素105B,115B,硼元素的原子量为10.8,则硼元素 中105B的质量分数约为( )
A.20% B.80% C.18.5% D.21.5%
15.为实现中国2000年消除碘缺乏病的目标,卫生部规定食盐必须加碘,其中的碘以碘酸钾( KIO3)形式存在.已知在溶液中IO-3可和I-发生反应:IO-3+5I-+6H+=3I2+3H2O,根据此反应,可用试纸和一些生活中常见的物质进行实验,证明在食盐中存在IO-3.可供选用的物质有:①自来水、②蓝色石蕊试纸、③碘化钾淀粉试纸、④淀粉、⑤ 食糖、⑥食醋、⑦白酒.进行上述实验时必须使用的物质是( )
A.①③ B.③⑥ C.②④⑥ D.①②④⑤⑦
16.密度为0.91g/cm3的氨水,质量分数为25%.该氨水用等体积的水稀释后,所得溶液中 溶质的质量分数( )
A.等于12.5% B.大于12.5%
C.小于12.5% D.无法确定
17.甲、乙两化合物均由X、Y两元素组成.甲的化学式为YX2,其中Y的质量分数是44%,又 知乙中Y的质量分数为30.77%,则乙的化学式为( )
A.YX B.YX2 C.YX3 D.Y2X3
18.摩尔质量为Mg/mol的某物质在20℃时的溶解度为Sg/100g水,其20℃的饱和溶液的密度是dg/cm3,则该饱和溶液的物质的量浓度是( )
A.![]() B.
B.![]()
C.![]() D.
D.![]()
19.溶液中氧化剂XO-3的含量有1.2×10-3mol,与300mL0.1mol/L亚硫酸钠溶液恰好反应完全,则还原产物中元素X的价态是( )
A.+2 B.-2 C.+1 D.0
二、实验题
20.下列有关使用托盘天平的叙述,不正确的是(填写标号) .
A.称量前先调节托盘天平的零点;
B.称量时左盘放被称量物,右盘放砝码;
C.潮湿的或具有腐蚀性的药品,必须放在玻璃皿里称量,其它固体药品可直接放在天平托盘上称量;
D.用托盘在平可准确称量至0.01g;
E.称量完毕,应把砝砝放回砝码盒中.
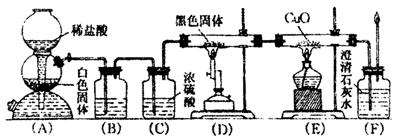 |
21.为了证明CO具有还原性,有人设计了如图所示的实验.
(1)装置B的最适宜的试剂是 .
(2)装置D中发生反应的化学方程式是 .
(3)必须用装置C吸收除去气体中水蒸气的理由是 .
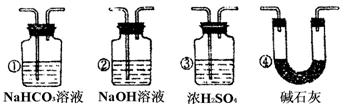 |
(4)若根据F中石灰水变浑浊的现象也能确认CO具有还原性,应在下图中装置 与 之间连下图所示的 装置(填序号).
三、填空题
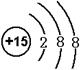
22.A、B、C、D为短周期中相邻两周期中的元素,其原子序数A>B>C>D,D和A形成简单离 子后,它们的电子层相差两层,已知A处于第n族,D处于第m族,且A单质中含有共价键,B的气态氢化物的分子式为H2B,在其最高价氧化物中B的质量分数为40%,B原子核内质子数和中子数相等,C和A形成CA3型化合物,C与A、B在同一周期,B与A左右相邻,试回答:
(1)C离子的结构示意图为
(2)向B的氢化物的水溶液中滴入A单质的水溶液,发生反应的化学方程式为
.
(3)向A、C形成的化合物的水溶液中滴入氨水,其反应的离子方程式为
.
23.近年来,科学家们在氦的气氛中对石墨电极通电,石墨发生挥发,在它挥发的黑烟中发 现一种新的碳分子——C60·C60分子的构型像个足球,相对分子质量为 ;C60与金刚石之间互为 ;C60的熔点比金刚石的熔点 (填 “高”、“低”).
24.有50mL氢气和氯气的混合气体,经光照发生爆炸反应后恢复到原来的温度和压强,发现 体积仍是50mL.试回答:
(1)若H2反应完全而Cl2有剩余,用实验进行验证的方法是 ;
(2)若H2与Cl2恰好完全反应,用实验进行验证的方法是 .
25.X、Y、Z、W四种元素都是短周期元素,且原子序数W>Z>Y>X.已知:X与Y的原子的最外 层电子数之和与Z原子最外层电子数相等;X的阳离子半径是自然界中离子半径最小的;W和 Y原子的最外层电子数之和是Z原子最外层电子数的2倍;W原子的最外层电子数为其电子层数 的3倍.试回答:
(1)写出元素符号:X 、Y 、Z 、W .
(2)上述元素单质中熔点最高的是 .
(3)由上述四种元素组成的离子晶体在300℃完全分解为气态混合物,且混合气体的平均相对分子质量为24.该离子晶体的化学式是 .
四、计算题
26.将某温度下的KNO3溶液200g蒸发掉10g水恢复到原温度,或向其中加入10gKNO3固体 均可使溶液达到饱和.试计算:
(1)该温度下KNO3的溶解度.
(2)原未饱和溶液中溶质的质量分数.
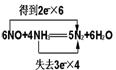
27.在一定条件下,NO跟NH3可以发生反应生成N2和H2O,现有NO和NH3的混合物1mol ,充分反应后所得产物中,若经还原得到的N2比经氧化得到的N2多1.4g.
(1)写出反应的化学方程式,并标出电子转移的方向和数目.
(2)若以上反应进行完全,试计算原反应混合物中NO与NH3的物质的量可能各是多少?
高一(下) 化学期末考试试题(A卷)参考答案
一、1.B 2.A 3.C 4.D 5.CD 6.A 7.AB 8.C 9.CD 10.AB 11.AD 12.C 1 3.A 14.C 15.B 16.C 17.C 18.D 19.D
二、20.C、D
21.(1)饱和NaHCO3溶液
高温
![]() (2)C+CO2
2CO
(2)C+CO2
2CO
(3)高温下,水蒸气与炭反应产生CO和H2、H2也能还原CuO
(4)D;E;④
三、22.(1)
![]() (2)H2S+Cl2
S↓+2HCl
(2)H2S+Cl2
S↓+2HCl
![]() (3)Al3++3NH3·H2O Al(OH)3↓+3NH4+
(3)Al3++3NH3·H2O Al(OH)3↓+3NH4+
23.720、同素异形体、低
24.(1)用KI淀粉试纸润湿后接触待测气体,若变蓝、说明氯气有利余
(2)将反应后气体的取样于试管或集气瓶中倒立于水槽里,水立即充满容器,说明H 2和Cl2恰好完全反应。
25.(1)H、C、N、O
(2)C
(3)(NH4)2CO3
 四、26.(1)100g
四、26.(1)100g
(2)47.5%
27.(1)
(2)0.3mol NO 和0.7molNH3
0.8mol NO 和 0.2molNH