高一化学(下)第一次月考试题
化 学 试 题
一、选择题(以下只有一个答案)
1、据最新报道,放射性元素![]() HO可有效治疗肝癌。该同位素原子核内的中子数与核外电子数之差为(
)
HO可有效治疗肝癌。该同位素原子核内的中子数与核外电子数之差为(
)
A、32
B、67 C、99 D、166
2.一种比黄金贵百倍的818O2气体,不久前在兰州近代物理研究所制备成功。1mol818O2气体中所含中子的物质的量为( )
A.16mol B.18mol C.20mol D.24mol
3.含硒(Se)的保健品已开始进入市场。已知硒与氧同主族,与钾同周期,则下列关于硒的叙述中,正确的是( )
A.非金属性比硫强 B.氢化物比HBr稳定
C.原子序数为34 D.最高价氧化物的水化物显碱性
4.下列元素中,最高正化合价数值最大的是( )
A.C B.S C.F D.Ne
5.下列化合物中,阳离子半径与阴离子半径比值最小的是( )
A.NaF B.NaCl C.MgI2 D.KBr
6.医学研究证明,用放射性53135I治疗肿瘤可收到一定疗效,下列有关53135I的叙述正确的是( )
A.53153I是碘的一种同素异形体 B.53135I是一种新发现的元素
C.53135I核内的中子数与核外电子数之差为29
D.53135I位于元素周期表中第4周期ⅦA族
7.物质的量相同的Mg2+、F-、H2O三种微粒,一定含有相同的( )
A.电子数 B.质子数 C.中子数 D.质量数
8.下列说法正确的是( )
A.难失电子的原子,得电子的能力一定强
B.易得电子的原子,失电子的能力一定弱
C.电子层结构相同的单核离子,阳离子半径一定比阴离子半径大
D.任何原子的原子核都是由质子和中子构成的
9.已知a、b分别为同周期的ⅠA和ⅦA族的两种元素,它们的原子序数分别为m和n,则下列关系不可能成立的是( )
A.n=m+16 B.n=m+6 C.n=m+30 D.n=m+10
10.A、B为同主族的两元素,A在B的上一周期,若A的原子序数为n,则B的原子序数不可能为( )
A.n+8 B.n+18 C.n+32 D.n+20
11.元素周期表的第7周期称为不定全周期,若将来发现的元素把第7周期全排满,则下列推论错误的可能性最大的是( )
A.该周期的元素都是放射性元素 B.该周期的元素,原子序数最大为118
C.该周期的ⅦA族元素是金属元素
D.该周期的ⅢA族的元素的氢氧化物具有两性
12.正电子、负质子等都属于反粒子,它们跟普通电子、质子的质量、电量均相等,而电性相反。科学家设想在宇宙的某些部分可能存在完全由反粒子构成的物质——反物质。1997年年初和年底,欧洲和美国的科研机构先后宣布:他们分别制造出9个和7个反氢原子。这是人类探索反物质的一大进步。你推测反氢原子的结构是 ( )
A. 由1个带正电荷的质子与1个带负电荷的电子构成
B. 由1个带负电荷的质子与1个带正电荷的电子构成
C. 由1个不带电的中子与1个带负电荷的电子构成
D. 由1个带负电荷的质子与1个带负电荷的电子构成
二、选择题(以下有一至两个答案)
13.X、Y、Z三种元素的原子,其核外电子排布分别为:X原子最外层有一个电子,Y原子的第一、二、三层电子数分别为2、8、3,Z原子第一、二层电子数为2、6,由这三种元素组成的化合物的化学式可能是( )
A.![]() B.
B.![]() C.
C.![]() D.
D.![]()
14.某电子层当它作为最外层时,最多只能容纳8个电子,当它作为次外层时,最多只能容纳18个电子,该电子层可能是( )
A.M层 B.K层 C.L层 D.P层
15.下列有关电子云及示意图的说法正确的是 ( )
A. 电子云是笼罩在原子核外的云雾 B. 小黑点多的区域表示电子多
C. 小黑点疏的区域表示电子出现机会少 D. 电子云是用高速照相机拍摄的照片
16.下列各组中的离子能在溶液中大量共存的是( )
A.K+、 H+、SO42-、OH- B.Na+、Cu2+、Cl-、 SO42-
C.Na+、H+、Cl-、 CO32- D.Na+、Ca2+、CO32-、NO3-
17.下列变化中,必须加入氧化剂才能发生的是( )
A.SO2→S B.SO32-→SO2 C.I-→I2 D.HCO3-→CO32-
18. 在标准状况下,a L HCl气体溶于1000g水中,得到盐酸的密度为b g/cm3,则该盐酸的物质的量浓度为( )
A.a/22.4 mol/L B.ab/22400 mol/L
C.ab/(22400+36.5a) mol/L D.1000ab/(22400+36.5a) mol/L
19. 饱和氯水长期密封放置后,下列微粒在溶液中不会明显减少的是( )
A. Cl2 B. HClO C. ClO- D. Cl-
20.能说明A元素非金属性比B元素非金属性强的是( )
A.A原子得到电子的数目比B原子少
B.A元素的最高正价比B元素的最高正价要高
C.气态氢化物溶于水后的酸性:A比B强
D.A单质能与B的氢化物水溶液反应,生成B单质
21.有物质的量相等的短周期金属元素单质A和B,在A中加入足量盐酸,在B中加入足量稀硫酸,反应完全后,生成氢气的体积分别为V1和V2,且V1≠V2,若要确定生成物中A和B的化合价,至少还需要的数据是( )
A.V1∶V2的值 B.V1和V2的值
C.A和B的物质的量 D.盐酸和稀硫酸的浓度
22.已知X+、Y2+、Z-、W2-四种离子均具有相同的电子层结构。下列关于X、Y、Z、W四种元素的描述,不正确的是( )
A.原子半径:X>Y>Z>W B.原子序数:Y>X>Z>W
C.原子最外层电子数:Y>X>Z>W D.金属性:X>Y,还原性:W2->Z-
三、填空题
23.有A、B、C、D、E五种微粒,其中A、B、C、D组成中有氢元素,且电子总数均为10个,A是双原子的阴离子,它们之间能发生下列变化:
(1)A+B![]() C+D↑
(2)C+Na
C+D↑
(2)C+Na ![]() A+E
(3)D+H+
A+E
(3)D+H+![]() B
B
由此可知它们的化学式分别为:
A ,B ,C ,D ,E 。
24.A、B、C、D四种短周期元素,原子序数D>A>B>C,且A、B同周期,C、D同主族,A的原子结构示意图为: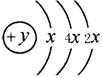 ,B、C可形成离子化合物B3C2,据此填空:
,B、C可形成离子化合物B3C2,据此填空:
(1)A的元素名称为 ,其气态氢化物的化学式为 。
(2)A、B、C、D四种元素的原子,半径由小到大的顺序为 。
(3)B和C最高价氧化物的水化物化学式分别为 和 。
25、核外电子分层排布的一般规律是:各电子层最多容纳的电子数为____个,最外层电子数目不超过______个,次外层电子数目不超过_____个,倒数第三层电子数目不超过_____个,核外电子总是尽先排在能量_____的电子层里,然后由里往外,依次排布在能量逐步______的电子层里。
26、带有2个单位正电荷的粒子“![]() X2+”,其中A是137,中子数是81。那么该粒子的核电荷数是_______,核外电子数是_______。
X2+”,其中A是137,中子数是81。那么该粒子的核电荷数是_______,核外电子数是_______。
27.短周期元素的A、B、C在元素周期表中的位置如图所示,已知A、B、C三种元素的原子核外电子数之和等于B的质量数,B原子核内质子数和中子数相等。据此填空:
| A | C | |
| B |
(1)A的氢化物分子式为 ,
(2)B的元素符号为 ,原子结构示意图为 ,在周期表中位于第 周期族;
(3)C的单质分子式为 ,C的单质溶于水所得溶液叫 。
四.实验题
28.欲配制一定物质的量浓度的氢氧化钠溶液250mL,完成下列步骤:
①用托盘天平称量NaOH固体的质量,若左盘上放有8g砝码,游码位置如下图,天平的指针在标尺中间,则所称NaOH固体的实际质量为__________g。
②将称好的氢氧化钠固体放入 中,加蒸馏水将其全部溶解,待
后,将溶液沿 移入 mL的容量瓶中。
③用蒸馏水洗涤溶解所用仪器 次,将洗涤液移入 中,在操作过程中不能损失点滴液体,否则会使溶液的浓度偏 (高或低)。
④向容量瓶内加水至接近刻度线1~2cm处时,改用 ______小心地加水至溶液凹液面与刻度线相切,若加水超过刻度线,会造成溶液浓度偏________,应该_________。
⑤最后盖好瓶盖,_________,将配好的溶液移入_________中并贴好标签。
29.在实验室中用二氧化锰跟浓盐酸反应制备干燥纯净的氯气。进行此实验,所用仪器如下图:
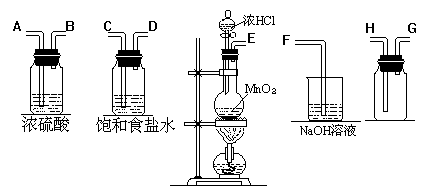
(1)连接上述仪器的正确顺序是(填各接口处的字母):
__ __接_ __,__ _接_ __,_ __接__ __,_ _接__ __。
(2)在装置中①饱和食盐水起的作用是_ _,②浓硫酸起的作用是_ _。
(3)写出下列化学反应的离子方程式:气体发生装置中进行的反应_ _。
五、计算题
30.某核素ZAX的氯化物XCl21.11g配成溶液后,需用1mol/L的硝酸银溶液20mL才能把氯离子完全沉淀下来,试计算:
(1)X的质量数。
(2)若X的核内中子数为20,求37gXCl2中所含质子的物质的量是多少?
31.(16分)由氧元素的两种同位素16O和18O所形成的两种气体单质18Om和16On,在同温同压同体积时,中子数之比为5:6。求:
⑴m:n值为多少?
⑵18Om对16On的质量比是多少?
以下为草稿纸
建宁三中高一化学2003-2004学年(下)第一次月考
化 学 试 题(答题卡)
一、选择题
| 题号 | 1 | 2 | 3 | 4 | 5 | 6 | 7 | 8 | 9 | 10 | 11 | 12 |
| 答案 | C | C | C | B | C | C | A | B | D | D | D | B |
二、选择题
| 题号 | 13 | 14 | 15 | 16 | 17 | 18 | 19 | 20 | 21 | 22 |
| 答案 | AD | AD | C | B | C | D | D | D | A | AC |
三、填空题
23、A OH- ,B NH4+ ,C H2O
D NH3 ,E Na+ 。
24.(1) 硅 , SiH4 。
(2) N<P<Si<Mg 。(3) Mg(OH)2 和 HNO3 。
25、__2n2__个, __8____个, __18___个, __32___个, __低__ ___高___
26、__56_____,核外电子数是_54_____。
27.(1)A的氢化物分子式为 ,(2)B的元素符号为 ,
原子结构示意图为 ,在周期表中位于第 周期族;
(3)C的单质分子式为 ,C的单质溶于水所得溶液叫 。
四.实验题
28.①__________g。② 移入 mL的容量瓶中。
③ 次,将洗涤液移入 中,偏 (高或低)。
④改用 ______偏________,应该_________。
⑤最后盖好瓶盖,_________,将配好的溶液移入_________中并贴好标签。
29. (1) __ __接_ __,__ _接_ __,_ __接__ __,_ _接__ __。
(2)在装置中①饱和食盐水起的作用是_ _,②浓硫酸起的作用是_ _。
(3)写出下列化学反应的离子方程式:气体发生装置中进行的反应_ _。
五、计算题
30、解:
31.解:
参考答案
一、1.C 2.C 3.C 4.B 5.C 6.C 7.A 8.B 9.D 10.D 11.D 12.B
二、16.AD 17.B 18.AB 19.AC 20.B 21.AC 22.D 23.A 24.AC 25.BD
三、26.OH-,NH4+,H2O,NH3,H3O+ 27.(1)硅,SiH4 (2)N<P<Si<Mg (3)Mg(OH)2 HNO3 28.6,ⅠB
29.[∶![]()
![]() ]-Ca2+[∶
]-Ca2+[∶![]()
![]() ]-,
]-,![]() ∶+
∶+![]() C
C![]() +∶
+∶![]()
![]()
![]() ∶
∶![]() C
C![]() ∶
∶![]()
30.70.7
31.(1)NH3,三角锥形,极性 (2)S,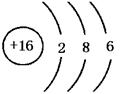 3,ⅥA (3)F2,氢氟酸。
3,ⅥA (3)F2,氢氟酸。
四、32.(1)H2 (2)甲烷
(3)H2O+C![]() CO+H2 33.F2、O2、H2、H2O、HF
CO+H2 33.F2、O2、H2、H2O、HF
五、34.(1)40 (2)18mol 35.150ml或750ml 36.3∶1
四.实验题(共13分)
27. (除标注外,其余每空1分)
① 4.8(2分)。 ②
烧杯(0.5分),冷却 玻璃棒(0.5分) 250 。
4.8(2分)。 ②
烧杯(0.5分),冷却 玻璃棒(0.5分) 250 。
③ 2~3, 容量瓶, 低。
④胶头滴管 低, 重新配制。
⑤ 将容量瓶上下翻转反复摇匀 , 试剂瓶