高一年级化学第一次阶段性考试试卷
命题王芳: 审核:陈红昌
总分:100分 时限:90分钟
可能用到的相对原子质量: H—1 O—16 Cl—35.5 Ca—40 Al—27
Na—23 K—39 S—32 C—12
一、选择题(每小题只有一个选项正确,本题包括25个小题,每题2分,共50分)
1、国际上提出“绿色化学”是提防污染的基本手段之一。下列选项中属于绿色化学的是( )
A.杜绝污染源 B.治理污染点 C.处理废弃物 D.减少毒物排放
2、C60是60个碳原子形成的封闭笼状分子,形似足球![]() ,它与石墨互为(
)
,它与石墨互为(
)
A.同位素 B.同素异形体 C.同分异构体 D.同一物质
3、在下列有关晶体的叙述中错误的是( )
A.离子晶体中,一定存在离子键 B.原子晶体中,只存在共价键
C.金属晶体的熔沸点均很高 D.稀有气体的原子能形成分子晶体
4、下列晶体或分子中,含有化学键类型有差异的一组是( )
A. H2O、CO2 B.MgF2、H2O2 C.NaOH、Ba(OH)2 D. NaCl、KCl
5、 与10 g H216O所含中子数相等的D216O ,其质量最接近于( )
A. 6 . 7 g B. 8 . 9 g C. 10 . 2 g D. 12 . 4 g
6、一些科学家预言,存在稳定的超重元素,如:中子数为184的原子,它位于元素周期表第七周期,第ⅣA族。由此,下列说法正确的是( )
A.第七周期有50种元素 B.该原子的质子数是184
C.该元素的相对原子质量是298 D.该原子核外有114个电子
7、下列各组物质性质的比较正确的是( )
A.酸性:H3PO4>H4SiO4>H2CO3 B.熔沸点:F2<Cl2<Br2
C.离子半径:S2-<Cl-<K+ D.熔点:Rb>K>Na
8、下列化学用语的书写,正确的是( )
A.氮气的电子式:![]() B.硫原子的结构示意图:
B.硫原子的结构示意图: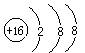
C.溴化钠的电子式:
![]() D.水分子的结构式:
D.水分子的结构式:![]()
9、下列化合物中,阳离子和阴离子的半径之比最大的是( )
A.CsF B.NaF C.LiI D.KCl
10、设NA代表阿伏加德罗常数的值,则下列说法中不正确的是( )
A.28克铁与足量盐酸反应时失去的电子数为NA
B.在标准状况下,22.4L由氢气和氧气组成的混合气体中,所含有的分子总数为NA
C.体积为5.6L的CH4气体中所含氢原子数为NA
D.在常温常压下,金属从硫酸中置换出0.5molH2,转移的电子数为NA
11、在2A+B=3C+4D反应中,表示该反应速率最快的数据是 ( )
A.υA = 0.5mol/(L·s) B.υB = 0.3mol/(L·s)
C.υC = 0.8mol/(L·s) D.υD = 1.0mol/(L·s)
12、下列各组微粒具有相同质子数和电子数的是( )
A.OH- 和NH4+ B. H2O和NH3 C. F 和OH- D. O2-和NH4+
13、A 、B分别为第三、四两周期同一主族的不同元素的原子,它们原子核内的质子数等于中子数。① 若A为ⅡA族,其质量数为X ,则B的质子数为Y;② 若A为ⅣA族,其质子数为m ,则B质量数为n ,则Y和n的值是( )
A.(X/2+18 ) 和 ( 2 m +18 ) B.(X/2+8 ) 和 ( 2 m +18 )
C.(X/2+8 ) 和 ( 2 m +36 ) D.(X/2+18 ) 和 ( 2 m+36 )
14、将一小块金属钠投入CuSO4溶液中,生成物有( )
A. Cu、Na2SO4 B. Cu、Na 2SO4、H2
C. Na 2SO4、Cu(OH)2、H2 D. NaOH、Cu、H2
15、已知自然界氧的同位素有16O、18O,氢的同位素有H、D、T,从水分子的原子组成来看,自然界的水一共有( )
A.3种 B.6种 C.9种 D.12种
16、元素B的最高正价和负价的绝对值之差为6,B元素和A元素原子的次外层都有8个电子,AB2在水溶液中电离出电子层结构相同的离子,则AB2是( )
A.MgF2 B.CaCl2 C.K2S D.Na2O
17、已知在25℃,101kPa下,l gC8H18(辛烷)燃烧生成二氧化碳和液态水时放出48.40kJ热量。表示上述反应的热化学方程式正确的是( )
A.C8H18(1)+22.5O2(g)=8CO2(g)+9H2O(g)△H=-48.40kJ·mol-1
B.C8H18(1)+22.5O2(g)=8CO2(g)+9H2O(1)△H=-5518kJ·mol-1
C.C8H18(1)+22.5O2(g)=8CO2(g)+9H2O(1)△H=+5518kJ·mol-1
D.C8H18(1)+22.5O2(g)=8CO2(g)+9H2O(1)△H=-48.40kJ·mol-1
18、A、B、C、D分别代表四种元素,如果 aAm+、bBn+、cCn-、dDm-四种离子的电子层结构相同(a、b、c、d为元素的质子数),下列关系正确的是( )
A.a-c=m-n B.a-b=n-m C.c-d=m+n D.b-d=n+m
19、下列物质的性质与氢键无关的是( )
A.冰的密度比液态水的密度小 B.NH3易液化
C.NH3分子比PH3分子稳定 D.在相同条件下,H2O的沸点比H2S的沸点高
20、现有如下各说法:
①在水中氢、氧原子间均以化学键相结合。
②金属和非金属化合形成离子键。
③离子键是阳离子、阴离子的相互吸引。
④根据电离方程式![]() ,判断HCl分子里存在离子键。
,判断HCl分子里存在离子键。
⑤H2分子和Cl2分子的反应过程是H2、Cl2分子里共价键发生断裂生成H、Cl原子,而后H、Cl原子形成离子键的过程。
上述各种说法正确是( )
A.①②⑤正确 B.都不正确 C.④正确,其他不正确 D.仅①不正确
21、下列反应的离子方程式书写正确的是( )
A.铁和稀盐酸反应 2Fe+6H+ 2Fe3++3H2↑
B.CO2通入足量澄清石灰水 CO2+2OH- H2O+CO32-
|
D.电解饱和食盐水 2Cl-+2H2O Cl2+H2+2OH-
![]() 22、将2mol SO2和1mol O2充入一容积固定的密闭容器中,在一定条件下反应:2SO2(g)+
O2(g) 2SO3(g),下列哪些情况能说明化学反应已达平衡状态的是( )
22、将2mol SO2和1mol O2充入一容积固定的密闭容器中,在一定条件下反应:2SO2(g)+
O2(g) 2SO3(g),下列哪些情况能说明化学反应已达平衡状态的是( )
A.单位时间内生成2mol SO2,同时消耗2mol SO3 B.混合气体的密度不再变化
C.单位时间内生成2mol SO3,同时消耗1mol SO2 D.混合气体的压强不再变化
23、V mL Al2(SO4)3溶液中含有Al3+a g,取![]() V mL溶液稀释到4V mL,则稀释后溶液中的SO42-的物质的量浓度是( )
V mL溶液稀释到4V mL,则稀释后溶液中的SO42-的物质的量浓度是( )
A.![]() mol/L B.
mol/L B.![]() mol/L
C.
mol/L
C.![]() mol/L D.
mol/L D.![]() mol/L
mol/L
24、 镁、锂在元素周期表中具有特殊的“对角线”位置关系,它们的性质相似,例如,它
们的单质在过量氧气中燃烧时均只能生成正常的氧化物 …… 等。以下叙述锂的性质正确的是( )
A. Li2SO4难溶于水 B. Li与水剧烈反应
C. LiOH是易溶于水,受热不分解的强碱 D. Li2CO3受热分解,生成Li2O和CO2
25、某种由K 2 S和Al 2 S 3 组成的混合物中,这两种组分的物质的量之比为3∶2 ,那么
含有32 g 硫元素的该混合物的质量是( )
A. 35 g B. 50 g C. 60 g D. 70 g
二、填空题(本题包括6小题,共42分)
26、(4分) 书写下列微粒的电子式:
⑴ CO2 ; ⑵ HClO ;
⑶ Na2O ; ⑷ Ca (OH)2 。
27、(4分)元素周期表中第16纵行的原子最外层上都有 个电子,其代表性元素硫的原子结构示意图为: ,在实验室或在使用汞的场合中,常用 来处理散落的汞滴。硫在加热的条件下也能和铁反应,其反应的化学方程式为: 。
28、(6分)化学物质呈现五颜六色,化学变化色彩纷呈,以下过程中就涉及许多颜色变化:
氯化铁溶液呈黄色,①当加入过量铁粉充分反应后就变成浅绿色,②然后隔绝空气下加入氢氧化钠溶液,会产生白色沉淀,③加入盐酸又变为浅绿色,④通入氯气变为黄色,⑤当加入铜后,黄色消失,溶液带有蓝色,⑥插入一根铁棒后,看到亮红色物质,溶液蓝色消失,变为浅绿色。
(1)上述反应中,属于氧化还原反应的有(填序号)
(2)写出②⑤化学反应的离子方程式
![]() ②
②
![]() ⑤
⑤
29、(10分)在①![]() Li、②
Li、②![]() N、③
N、③![]() Na、④
Na、④![]() Mg、⑤
Mg、⑤![]() Li、⑥
Li、⑥![]() C、⑦C60、⑧NH4CNO、⑨CO(NH2)2、、⑩石墨,中:
C、⑦C60、⑧NH4CNO、⑨CO(NH2)2、、⑩石墨,中:
(1) 和 互为同位素。(填序号,下同)
(2) 和 质量数相等,但不能互称同位素。
(3) 和 的中子数相等,但质子数不相等,所以不是同一种元素。
(4) 和 互为同素异形体, 和 互为同分异构体。
30、(8分)某元素X的碳酸氢盐 [X(HCO3)2] 在高温下完全分解的产物都是氧化物,现取3.24g这种碳酸氢盐高温完全分解后得到1.12g固体,又知X的原子核里有20个中子。
![]()
![]() (1)通过计算确定X是 元素(填名称),并写出它在元素周期表中的位置 ;
(1)通过计算确定X是 元素(填名称),并写出它在元素周期表中的位置 ;
![]() (2)写出X的单质与水反应的化学方程式
(2)写出X的单质与水反应的化学方程式
![]() 已知该元素的金属性比钠强,但其单质与水反应没有钠那样剧烈,试分析其原因:
已知该元素的金属性比钠强,但其单质与水反应没有钠那样剧烈,试分析其原因:
![]()
31、(10分)已知X、Y、Z、W是短周期中四种非金属元素,它们的原子序数依次增大。X元素原子形成的离子就是一个质子,Z、W在元素周期表中处于相邻的位置,它们的单质在常温下均为无色气体,Y原子的最外层电子数是内层电子数的2倍。
(1)写出元素符号:X ;Y ;Z ;W 。
(2)X单质和Z单质在一定条件下反应生成化合物E,该反应的化学方程式为(注明反应条件) ;E分子的空间构型为 。
![]() (3)这四种元素可组成原子个数比为5∶1∶1∶3的化合物(按X、Y、Z、W的顺序),该化合物的水溶液与足量浓NaOH溶液反应的离子方程式为
(3)这四种元素可组成原子个数比为5∶1∶1∶3的化合物(按X、Y、Z、W的顺序),该化合物的水溶液与足量浓NaOH溶液反应的离子方程式为
三、计算题(本题包括1个小题,共8分)
32、(8分)在一体积固定的密闭容器中加入反应物A、B,发生如下反应:
A(g)+3B(g)== 2C(g)。反应经2min后,A的浓度从开始时的1.20mol·L-1 下降到0.9mol·L-1 ,已知B的起始浓度为1.6mol·L-1。求:
(1) 2min 末B、C的浓度。
(2)以单位时间内B的浓度的减小和C的浓度的增加来表示2min 内该反应的平均速率。