高一年级化学第二学期期中考试试题
化学试卷
一、选择题(每小题2分,每题只有一个选项符合题意,共16分)
1.我国的“神州六号”载人飞船已发射成功,“嫦娥”探月工程已正式启动。据科学家预测,月球的土壤中吸附着数百万吨的32He,每百吨32He核聚变所释放出的能量相当于目前人类一年消耗的能量。在地球上,氦元素主要以42He的形式存在。下列说法正确的是 ( )
A.42He原子核内含有4个质子
B.32He和42He互为同位素
C.32He原子核内含有3个中子
D.42He的最外层电子数为2,所以42He具有较强的金属性
2、2005年4月22日是第36个“世界地球日”,我国国土资源部确定今年“世界地球日”的主题为“善待地球—科学发展,构建和谐”。你认为下列行为中不符合这一主题的是( )
A.开发太阳能、水能、风能、可燃冰等新能源、减少使用煤、石油等化石燃料
B.控制含磷剂的生产和使用,防止水体富营养化,保护水资源
C.研究采煤、采油新技术,尽量提高产量以满足工业生产的快速发展
D.实现资源的“3R”利用观,即:减少资源消耗(Reduce)、增加资源的重复使用(Reuse)、资源的循环再生(Recycle)
3、下列性质中,可证明某化合物内一定存在离子键的是 ( )
A、可溶于水 B、具有较高的熔点 C、水溶液能导电 D、熔融状态能导电
4、元素性质呈周期性变化的根本原因是 ( )
A.相对原子质量逐渐增大 B.核电荷数逐渐增大
C.核外电子排布呈周期性变化 D.元素的化合价呈周期性变化
![]() 5、下列微粒中:①
5、下列微粒中:①![]() ②
②![]() ③
④O2-,其核外电子数相同的是 ( )
③
④O2-,其核外电子数相同的是 ( )
A.①②③ B.②③④
C.①②④ D.①③④
6、下列变化中,吸收的热量用于克服分子间作用力的是 ( )
A、加热金属铝使之熔化 B、液氨受热蒸发
C、加热碘化氢气体使之分解 D、加热硅晶体使之熔化
7、在周期表中,第三、四、五、六周期元素的数目分别是 ( )
A、8、18、32、32 B、8、18、18、32
C、8、18、18、18 D、8、8、18、18
8.下列各组顺序的排列不正确的是 ( )
A.原子半径:Na<Mg<Cl B.热稳定性:HCl>H2S>PH3
C.酸性强弱:H2SiO3<H2CO3<H2SO4 D. 碱性强弱:LiOH <NaOH < KOH
二、选择题(每小题3分,每题有1—2个选项符合题意,错选得0分,漏选且有一个正确答案得1分,共36分)
9、下列说法错误的是 ( )
A、原子及其离子的核外电子层数等于该元素所在的周期数
B、元素周期表中从IIIB到IIB族10个纵行的元素都是金属元素
C、除氦以外的稀有气体原子的最外层电子数都是8
D、同周期元素中,除稀有气体外,ⅦA族元素的原子半径较小
10、下列说法正确的是 ( )
A、原子序数越大,原子半径一定越大
B、对同主族元素来说,电子层数多的原子半径比电子层数少的大
C、元素性质周期性变化不是元素性质的简单重复
D、按C、N、O、F的顺序,元素的最高正价依次升高
11、下列说法正确的是 ( )
A、SO2和SO3互为同分异构体 B、液溴和溴蒸气是同素异形体
C、金刚石和石墨都是由碳原子构成,因此它们是同种物质
D、乙醇和二甲醚互为同分异构体
12、沼气是一种能源,它的主要成分是CH4。0.5molCH4完全燃烧生成CO2和H2O时,放出445kJ热量,则下列热化学方程式中正确的是 ( )
A.2CH4(g)+4O2(g)=2CO2(g)+4H2O(l) ΔH=+890kJ·mol-1
B.CH4(g)+2O2(g)=CO2(g)+2H2O(l) ΔH=+890kJ·mol-1
C.CH4(g)+2O2(g)=CO2(g)+2H2O(l) ΔH=-890kJ·mol-1
D.1/2CH4(g)+O2(g)=1/2CO2(g)+H2O(l) ΔH=-890kJ·mol-1
 13、可逆反应达到平衡时
( )
13、可逆反应达到平衡时
( )
A、反应停止了 B、正、逆反应速率均为零
C、正、逆反应速率相等 D、各组份的浓度不再变化
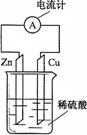
14.右图为铜锌原电池示意图,下列说法正确的是 ( )
A.锌片逐渐溶解
B.烧杯中溶液逐渐呈蓝色
C.电子由铜片通过导线流向锌片
D.该装置能将电能转变为化学能
15.将10mol A和5mol B放入10L真空箱内,某温度下发生反应:3A(气)+B(气) ![]() 2C(气)在最初0.2s内,消耗A的平均速率为0.06mol·(L·S)-1.则在0.2s时,真空箱中C的物质的量是
( )
2C(气)在最初0.2s内,消耗A的平均速率为0.06mol·(L·S)-1.则在0.2s时,真空箱中C的物质的量是
( )
A.0.12mol B.0.08mol C.0.04mol D.0.8mol
16、X元素原子的质量数为m,核内中子数为n,则Wg X2+ 离子含有的电子的物质的量约为( )
A、 (m+n+2)w/m mol B、 (m-n+2)w/m mol
C、 (m+n-2)w/m mol D、 (m-n-2)w/m mol
17、下列关于化学键的说法正确的是 ( )
A、构成单质分子的微粒一定含有共价键
B、由非金属元素组成的化合物不一定是共价化合物
C、非极性键只存在于双原子分子中
D、不同元素组成的多原子分子里的化学键一定是极性键
18、以下叙述中,错误的是 ( )
A.钠原子和氯原子作用生成NaCl后,其结构的稳定性增强
B.在NaCl中,除Na+和Cl-的静电吸引作用外,还存在电子与电子、原子核与原子核之间的排斥作用
C.任何离子键在形成的过程中必定有电子的得与失
D.离子化合物中不一定含金属元素
19、下列说法中正确的是 ( )
A、物质发生化学反应都伴随着能量变化
B、伴有能量变化的物质变化都是化学变化
C、在一个确定的化学反应中,反应物的总能量与生成物的总能量一定不同
D、在一个确定的化学反应关系中,反应物的总能量高于生成物的总能量
20、已知化学式为CxHy的物质在氧气中完全燃烧产物为水和二氧化碳。在常温常压下,将16mL H2、CH4、C2H2的混合气体与足量的O2混合,点燃后使之完全燃烧,冷却至原状态,测得总体积比原体积减小26mL,则混合气体中CH4的体积是 ( )
A.2mL B.4mL C.8mL D.无法计算
三、填空题(共36分)
21、(4分)有①质子数②中子数③核外电子数④最外层电子数⑤电子层数。请用上述序号回答:
(1)原子种类由 决定,元素种类由 决定。
(2)原子的质量数由 决定,主族元素在周期表中的位置由 决定。
22、(4分)以石墨棒为两极,氯化铜溶液为电解液组成的电解池的
阴极电极反应式是
阳极电极反应式是
电解反应的化学方程式为____________________________
在化学反应中发生的能量转变形式是_________________________
23、(10分)下图是元素周期表的一部分,表中的①~⑩中元素,回答下列填空:
|
周期 | ⅠA | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅦA | 0 |
| 二 | ① | ② | ||||||
| 三 | ③ | ④ | ⑤ | ⑥ | ⑦ | ⑧ | ||
| 四 | ⑨ | ⑩ |
⑴ 在这些元素中,化学性质最不活泼的原子的原子结构示意图为 ___________________
⑵ 除⑧外原子半径最大的元素是 _________,(填元素符号)非金属性最强的元素是_____________(填元素符号)
⑶写出①⑦对应两种元素的符号分别为______、_____,元素③⑤的最高价氧化物对应的水化物相互反应的离子方程式为____________________________
⑷用电子式表示②与④组成化合物的形成过程________________________________ 。
⑸这些元素中的最高价氧化物对应的水化物中,酸性最强的是(填对应化合物的化学式,下同)___________,碱性最强的是________________,呈两性的氢氧化物是 ________________。
24、(4分)推断下列化合物的化学式:
(1)第三周期内,A、B两元素的原子序数之差为4,它们组成的化合物AB,其化学式为______.
(2)1mol某物质含有不同周期的三种元素原子各1mol,其核电荷总数为20mol,该物质的化学式为______.
(3)X元素的最高正价和负价绝对值之差为6,Y元素和X元素原子的次外电子层上都有8个电子,X和Y形成的化合物在水溶液中能电离出电子层结构相同的离子,则X和Y所形成的化合物是______.
(4)某非金属X的最高正价为+m,它的最高正价氧化物对应的水化物形成的酸中有b个氧原子,则这种酸的化学式是________.
25. (4分)写出下列物质的结构式
氮气_____________________________二氧化碳______________________________
氨气_____________________________甲烷___________________________________
26.(6分)
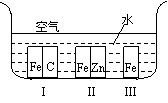 (1)如右图所示,铁处于Ⅰ、Ⅱ、Ⅲ三种不同的环境中,铁被腐蚀的速率由大到小的顺序是(填序号)_______________。
(1)如右图所示,铁处于Ⅰ、Ⅱ、Ⅲ三种不同的环境中,铁被腐蚀的速率由大到小的顺序是(填序号)_______________。
(2)氟氯代烷是一种能破坏臭氧层的物质。在大气平流层中,氟氯代烷受紫外线的照射分解出氯原子,氯原子参与下列有关反应:
①Cl+O3→ClO+O2 ②O3→O+O2 ③ClO+O→Cl+O2
上列的反应的总反应式是________________________,少量氟氯代烷能破坏大量臭氧的原因是___________________________________。
27、(4分)a、b、c、d、e、f、g为七种由短周期元素构成的微粒,它们都有10个电子,其结构特点如下:
| 微粒代码 | a | b | c | d | e | f | g |
| 原子核数 | 单核 | 单核 | 双核 | 多核 | 单核 | 多核 | 多核 |
| 带电荷数 | 0 | 1+ | 1- | 0 | 2+ | 1+ | 0 |
其中,b的离子半径大于e的离子半径;d是由共价键构成的四原子分子;c与f可形成两个共价型的g分子。
(1)a微粒的结构示意图为 。
(2)b与e相应元素的最高价氧化物对应水化物的碱性强弱相比较为 > 。
(3)f的电子式为 。
四、计算题(共12分)
28.(4分)由第ⅡA族金属单质A和第ⅢA族金属单质B组成的混合物1.29g ,用过量的盐酸其完全溶解后生成的氢气在标况下的体积为1.456L.若A和B的原子量之比为8:9,混合物中A和B的原子个数比为2:3,求A、B的的相对原子质量。
|
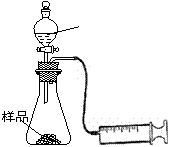
(1)在一个质量为ag的蒸发皿中加入一些样品,称得总质量为bg。用酒精灯对其充分加热,冷却后称得其总质量为cg。残留在蒸发皿中的固体是(填化学式)_________。
(2)另称取相同质量的样品放入锥形瓶中,实验装置如右图所示。为了保证实验成功,所选用针筒的最大刻度值应大于或等于_________(mL)。(设实验在标准状况下进行)
(3)打开活塞逐滴加入稀硫酸,至没有气泡产生为止。针筒中收集到气体折算成标准状况下的体积为VmL(滴入稀硫酸的体积及针筒活塞的内壁的摩擦力忽略不计)。该科研小组设称取的每份样品中的Na2CO3、NaHCO3的物质的量分别为x、y,且没有利用化学方程式进行计算,就列出了如下算式:x+y=VmL/22400mL·mol—1,他们依据的原理是_________。根据相似原理,请完成下列算式:2x+y=__________由上述两算式,该科研小组通过计算,得出了样品中的Na2CO3、NaHCO3的质量分数。
14班附加题
(本题10分)已知Cl2和NO2在一定条件下可以化合成一种气态化合物A。为了测定A的组成进行如下实验:
(1)(2分)当Cl2与NO2混合气体以不同比例混合时,测得其平均相对分子质量分别为51和61,分别求出Cl2在上述混合气体中的体积分数 、 。
(2)(2分)取上述不同比例的混合气体各5L,在一定条件下充分反应后,气体体积均为4L,由此写出Cl2和NO2反应的化学方程式 。
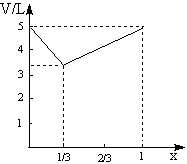
(3)(4分)设Cl2的体积分数为x(0<x<1),试讨论当x的取值不同时(Cl2与NO2的总体积为5L),反应后的总体积V随x变化的函数关系,将结果填入下表(可以不填满)
| X值 | V(反应后混合气体体积) |
(4)(2分)请在下图中画出反应后的总体积V随x变化的函数图象。
答案
一、选择题(每小题2分,每题只有一个选项符合题意,共16分)
| 题号 | 1 | 2 | 3 | 4 | 5 | 6 | 7 | 8 |
| 答案 | B | C | D | C | C | B | B | A |
二、选择题
(每小题3分,每题有1—2个选项符合题意,错选扣3分,漏选得1分,共36分)
| 题号 | 9 | 10 | 11 | 12 | 13 | 14 | 15 | 16 | 17 | 18 | 19 | 20 |
| 答案 | A | BC | D | C | CD | A | B | D | B | C | AC | B |
三、填空题(共36分)
21、(4分)(1)①②;①;(2)①②;④⑤;
22、(4分):
![]() (1)Cu2++2e-=Cu
(2)2Cl--2e-=Cl2
(1)Cu2++2e-=Cu
(2)2Cl--2e-=Cl2
![]() (3)CuCl2
(3)CuCl2![]() Cu+Cl2
(4)电能转变为化学能
Cu+Cl2
(4)电能转变为化学能
23、(10分,除方程式2分,每空1分)
⑴ ![]()
![]() ⑵ K , F⑶N,Cl
Al(OH)3+OH-=AlO2-+H2O
⑵ K , F⑶N,Cl
Al(OH)3+OH-=AlO2-+H2O
⑷ ![]() 。
。
⑸HClO4,KOH ,Al(OH)3
24、(4分)
(1)MgS (2)NaOH或LiHS(答对1个就给分)
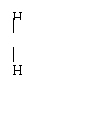 (3)KCl或CaCl2(答对1个就给分)(4)H2b-mXOb
(3)KCl或CaCl2(答对1个就给分)(4)H2b-mXOb
25、(4分)
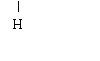 氮气 N≡N 二氧化碳O=C=O 氨气 H-N-H 甲烷H-C-H
氮气 N≡N 二氧化碳O=C=O 氨气 H-N-H 甲烷H-C-H
26.(6分,每空2分)(1)Ⅰ、Ⅲ、Ⅱ
(2)2O3![]() 3O2
氟氯代烷分解产生的Cl对O3的分解有促进作用
3O2
氟氯代烷分解产生的Cl对O3的分解有促进作用
27、.(4分)
⑴![]() ,⑵NaOH>Mg(OH)2;⑶
,⑵NaOH>Mg(OH)2;⑶![]() ;
;
四、计算题(共12分)
28.(4分)解:设A的原子量为8M,B的原子量为9M;A为2xmol,B为3xmol。
A+2HCl==ACl2+H2;2B+6HCl==2BCl3+3H2
2x 2x 3x 9x/2
2x+9x/2=1.456/22.4=0.065mol
2x*8M+3x*9M=1.29
所以x=0.01 M=3
则A的原子量为24;B的原子量为27。
28.(8分)每空2分(1)Na2CO3(2)(![]() +
+![]() )×22400(3)原子守恒
)×22400(3)原子守恒 ![]() ×2
×2
14班附加题答案:当C12占体积分数0.2时,即C12为1L时,反应后气体体积减少1L;当NO2占体积分数0.4时,即2L时,反应后气体体积也减少1L。根据阿伏加德罗定律可知,C12+2NO2=2NClO2,即A的化学式为NClO2,至此,不难求出当C12不足或NO2不足时,反应后总体积随C12所占体积分数变化的函数关系。
(1)20%;60%。
(2)发生反应的化学方程为 C12+2NO2=2NClO2
(3)
| X值 | V(反应后混合气体体积) |
| x≤ | V=(5-5x)L |
| x> | V=2.5(x+1)L |
(4) 
 族
族