高一年级化学第二学期期中试卷
[卷面总分:100分 考试时间:90分钟]
注意事项:
答题卡在指定的地方写姓名、班级,并必须用黑色字迹的钢笔或签字笔作答,答案必须写答题卡各题目指定区域内相应位置上。
可能用到的原子量:Cu-64 H-1 O-16 Zn-65 Na-23 Ca-40 C-12 Mg-24
第一卷 选择题(共52分)
一、选择题(每小题2分,每题只有一个选项符合题意,共16分)
1、质量数为37的原子应该有( )
A、18个质子、19个中子、19个电子
B、17个质子、20个中子、18个电子
C、19个质子、18个中子、20个电子
D、18个质子、19个中子、18个电子
2、下列各组微粒,半径之比大于1的是( )
A、Na+/Na B、Mg/Na C、Cl-/Cl D、P/Si
3、下列性质中,可证明某化合物内一定存在离子键的是( )
A、可溶于水 B、具有较高的熔点 C、水溶液能导电 D、熔融状态能导电
4、已知反应X+Y= M+N为吸热反应,对这个反应的下列说法中正确的是
A、X的能量一定低于M的,Y的能量一定低于N的
B、因为该反应为吸热反应,故一定要加热反应才能进行
C、破坏反应物中的化学键所吸收的能量小于形成生成物中化学键所放出的能量
D、反应物X和Y的总能量一定大于生成物M和N的总能量
5、![]() 原子的核外电子数( )
原子的核外电子数( )
A.大于 B.小于 C.等于 D.不能肯定
6、在周期表中,第三、四、五、六周期元素的数目分别是( )
A、8、18、32、32 B、8、18、18、32
C、8、18、18、18 D、8、8、18、18
7、下列电子式书写错误的是( ).
8、已知下列元素的原子半径为:( )
| 原子 | N | S | O | Si |
| 半径/10-10m | 0.75 | 1.02 | 0.74 | 1.17 |
根据以上数据,磷原子的半径可能是
A、0.80×10-10m B、1.10×10-10m C、1.20×10-10m D、0.70×10-10m
二、选择题(每小题3分,每题有1—2个选项符合题意,共36分)
9、下列说法中正确的是
A、镍氢电池、锂离子电池和碱性锌锰干电池都是二次电池
B、燃料电池是一种高效但是会污染环境的新型电池
C、化学电池的反应基础是氧化还原反应
D、铅蓄电池放电的时候正极是Pb负极是PbO2
10、下列说法正确的是( )
A、原子序数越大,原子半径一定越大
B、对主族元素来说,电子层数多的原子半径一般比电子层数少的大
C、元素性质周期性变化不是元素性质的简单重复
D、按C、N、O、F的顺序,元素的最高正价依次升高
11、下列说法中正确的是( )
A、原电池中电子流出的极为负极,发生氧化反应
B、原电池是将电能转化为化学能的装置
C、原电池中阴离子向正极移动
D、原电池正极上发生氧化反应
12、下列各组物质的性质比较中,正确的是( )
A、稳定性:NH3 < PH3 < SiH4 B、酸性:HClO4 > H2SO4 > H3PO4
C、碱性:KOH > NaOH > Mg(OH)2 D、氧化性:F2 < Cl2 < Br2
![]() 13、下列化学变化中,反应物的总能量低于生成物的总能量的是( )
13、下列化学变化中,反应物的总能量低于生成物的总能量的是( )
![]() A、2H2 + O2 2H2O B、CaCO3
CaO +CO2↑
A、2H2 + O2 2H2O B、CaCO3
CaO +CO2↑
![]() C、CaO + H2O
= Ca(OH)2 D、CH3CH2OH(酒精)+ 3O2 2CO2 + 3 H2O
C、CaO + H2O
= Ca(OH)2 D、CH3CH2OH(酒精)+ 3O2 2CO2 + 3 H2O
14、H2O和D2O分别跟金属钾反应,若电子转移的物质的量相等时,下列各量相等的是( )
A 消耗水和重水的质量 B 同温同压下生成的气体的体积
C 生成的气体的质量 D 参加反应的钾的物质的量
15、X元素原子的质量数为m,核内中子数为n,则Wg X2+ 离子含有的电子的物质的量约为( )
A、 (m+n+2)w/m mol B、 (m-n+2)w/m mol
C、 (m+n-2)w/m mol D、 (m-n-2)w/m mol
16、下列关于化学键的说法正确的是( )
A、构成单质分子的微粒一定含有共价键
B、由非金属元素组成的化合物不一定是共价化合物
C、非极性键只存在于双原子分子中
D、不同元素组成的多原子分子里的化学键一定是极性键
17、有AZX与A+1ZX+两种粒子的叙述正确的是( )
A、一定都由质子、中子和电子组成
B、化学性质几乎相同
C、质子数一定相同,质量数和中子数一定不同
D、核电荷数和核外电子数一定相同
18、下列微粒中,与NH4+的质子数和电子数都相同的是( )
|
|
A、NiO(OH) B、Ni(OH) 2 C、H2 D、H2和NiO(OH)、
20、下列说法中正确的是( )
A、物质发生化学反应都伴随着能量变化
B、伴有能量变化的物质变化都是化学变化
C、在一个确定的化学反应中,反应物的总能量与生成物的总能量一定不同
D、在一个确定的化学反应关系中,反应物的总能量高于生成物的总能量
第二卷 非选择题(共48分)
三、填空题(共29分)
21、(10分)下表标出的是元素周期表的一部分元素,回答下列问题:
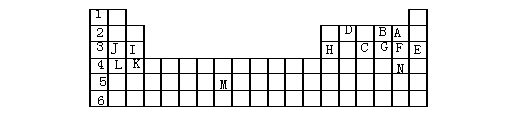 |
(1)表中用字母标出的15种元素中,化学性质最不活泼的是 (用元素符号表示,下同),金属性最强的是 ,非金属性最强的是 ,常温下单质为液态的非金属元素是 ,属于过渡元素的是 (该空用字母表示)
(2)B,F,C气态氢化物的化学式分别为 ,其中以 最不稳定。
(3)第三周期中原子半径最小的是 。
22、(4分)以下列出了四种物质的分子结构示意图。其中圆圈表示原子核以及包含除价电子以外的电子的示意图,黑点表示非共用电子对,直线表示共价键,且图中各分子仅是由一、二周期元素的原子构成的。在括号里填写四种物质的分子式。
(1)![]() (2)
(2)
![]()
(3) ![]() (4)
(4) ![]()
23、(5分)a、b、c、d、e、f、g为七种由短周期元素构成的微粒,它们都有10个电子,其结构特点如下:
| 微粒代码 | a | b | c | d | e | f | g |
| 原子核数 | 单核 | 单核 | 双核 | 多核 | 单核 | 多核 | 多核 |
| 带电荷数 | 0 | 1+ | 1- | 0 | 2+ | 1+ | 0 |
其中,b的离子半径大于e的离子半径;d是由极性键构成的四原子分子;c与f可形成两个共价型的g分子。
(1)A微粒的核外电子排布结构示意图为 。
(2)b与e相应元素的最高价氧化物对应水化物的碱性强弱相比较为 > 。
(3)d溶于水的电离方程式为 。
24、(4分)用电子式表示下列物质的形成过程:
N2:_____________________________________________________________________
K2S:_____________________________________________________________________
25、(6分)工业上合成氨的化学反应方程式为:N2+3H2![]() 2NH3。在某条件下,将2molN2和6molH2通入一容积为2L的密闭容器中,在催化剂存在时进行反应。2min后测得N2的物质的量为1.2mol,则在这2min内,以N2的浓度变化表示的平均反应速率为__________;同一时间内生成的NH3的物质的量为________,以NH3的浓度变化表示的平均反应速率为_____________,同理也可以算出以H2的浓度变化表示的平均反应速率。对比分别以N2、H2、NH3的浓度变化表示的反应速率数值,可以得出的结论是___ _
_______。
2NH3。在某条件下,将2molN2和6molH2通入一容积为2L的密闭容器中,在催化剂存在时进行反应。2min后测得N2的物质的量为1.2mol,则在这2min内,以N2的浓度变化表示的平均反应速率为__________;同一时间内生成的NH3的物质的量为________,以NH3的浓度变化表示的平均反应速率为_____________,同理也可以算出以H2的浓度变化表示的平均反应速率。对比分别以N2、H2、NH3的浓度变化表示的反应速率数值,可以得出的结论是___ _
_______。
四、试验题(共10分)
26、(1)高中老教材中有这样一个实验:在两支试管中分别加入3mL稀盐酸(均足量),将两个各装有0.3gNaHCO3或Na2CO3粉末的小气球分别套在两支试管口(如右图)。将气球内的NaHCO3或Na2CO3同时倒入试管中,观察到现象如下:
①I试管和II试管中分别发生的离子方程式:
_____________________________________________________;
_____________________________________________________;
②两支试管中的现象(填产生沉淀或气体及反应速率等相关现象)
____________________________________________________________;
③甲同学用手触摸试管,发现盛NaHCO3粉末的试管变冷,而盛Na2CO3的试管温度有升高。由此他得出:不管其状态如何,NaHCO3和HCl反应为吸热反应,而Na2CO3和HCl反应为放热反应。甲下结论的方法是否正确?____________________(填正确或不正确)。
(2)为研究是吸热还是放热反应,继续进行了下列实验(每次实验各做3次平行实验,取平均值):
| 序号 | 试剂1 | 试剂2 | 混合前 温度 | 混合后最高 或最低温度 |
| ① | 50mL水 | 2.5gNaHCO3固体 | 20℃ | 18.5℃ |
| ② | 35mL水 | 3.2gNa2CO3固体 | 20℃ | 23.3℃ |
| ③ | 35mL稀盐酸 | 含2.5gNaHCO3的饱和溶液15mL | 20℃ | 18.8℃ |
| ④ | 50mL稀盐酸 | 含3.2gNa2CO3饱和溶液15mL | 20℃ | 21.2℃ |
| ⑤ | 35mL稀盐酸 | 2.5gNaHCO3固体 | 20℃ | 17.4℃ |
| ⑥ | 50mL稀盐酸 | 3.2gNa2CO3固体 | 20℃ | 24.4℃ |
请你帮助填写相关内容:
①该研究报告的题目是《______________________》;
②该实验中所用的仪器除试管、药匙(或V型纸槽)、气球、环形玻璃搅拌棒、胶头滴管、烧杯、量筒、保温瓶外,还需要的仪器名称为__________和___________;通过上述实验可得出三条结论:
a:NaHCO3的溶解是_________________________(吸热或放热)过程;
b:Na2CO3的饱和溶液和盐酸的反应是__________(吸热或放热)反应;
c:NaHCO3的饱和溶液和盐酸的反应是__________(吸热或放热)反应。
五、计算题:(共8分)
27、在盛有500mL0.1mol/LCuSO4和0.4mol/LH2SO4混合溶液的大烧杯中。用锌、铜作电极,用导线连接形成原电池,当电极锌消耗6.5g时,试完成:(提示:在原电池反应中,Cu2+的氧化性比H+的氧化性要强)
(1)写出电极反应式:负极__________________;正极_______________________________。
(2)电极上共析出氢气的质量。
高一化学备课组
答题卡
班级 姓名
卷面总分:100分 考试时间:90分钟
第一卷:选择题(共52分)
一、选择题(每小题2分,每题只有一个选项符合题意,共16分)
| 题号 | 1 | 2 | 3 | 4 | 5 | 6 | 7 | 8 |
| 答案 |
二、选择题(每小题3分,每题有1—2个选项符合题意,共36分)
| 题号 | 9 | 10 | 11 | 12 | 13 | 14 | 15 | 16 | 17 | 18 | 19 | 20 |
| 答案 |
第二卷:非选择题(共48分)
三、填空题(共29分)
21、(10分)
(1) 。(2) (3) 。
22、(4分):
(1)( ),(2)( ),(3)( ),(4)( )
23、(5分)
(1)、 (2)、 (3)、
24、(4分)
(1)____ __.(2)___ ___.
25、(8分)。
(1) 。(2) 。(3) 。
(4)
四、试验题(共10分)
26、(1)① 。 。②
③
(2)① ,② a b c
五、计算题(共9分)
27、解:
高一化学备课组
开城中学2006~2007学年度第二学期高一年级化学期中试卷
答案
一、选择题(每小题2分,每题只有一个选项符合题意,共16分)
| 题号 | 1 | 2 | 3 | 4 | 5 | 6 | 7 | 8 |
| 答案 | D | C | D | D | C | B | A | B |
二、选择题(每小题3分,每题有1—2个选项符合题意,共36分)
| 题号 | 9 | 10 | 11 | 12 | 13 | 14 | 15 | 16 | 17 | 18 | 19 | 20 |
| 答案 | C | BC | A | BC | B | BD | D | B | C | BC | C | AC |
第二卷:非选择题(共48分)
三、填空题(共29分)
21、(10分):
(1) Ar , K , F , Br , M 。(2) H2O 、 HCl 、 PH3 , PH3 。(3) Cl 。
22、(4分)(1)( N2 ),(2)( HF ),(3)( H2O ),(4)( HCN )
23、(5分)
(1)、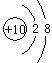 (2)、NaOH>Mg(OH)2 (3)、NH3+H2OÛNH4++OH
(2)、NaOH>Mg(OH)2 (3)、NH3+H2OÛNH4++OH
24、(4分)(略)
25、(6分) 0.2(mol/L.min) 1.6 mol 0.4(mol/L.min)
化学反应的速率之比等于各化学反应方程式计量数之比
四、试验题(共10分)
26、
(1)CO32-+2H+=CO2+H2O;HCO3-+H+=CO2+H2O;两支试管中都产生大量气泡,但盛NaHCO3的试管中反应速率要快得多;不正确;
(2)《NaHCO3、Na2CO3和盐酸反应过程中热效应的探究》;
托盘天平,温度计;吸;放;吸。
五、计算题(9分)
27、(1)负极: Zn-2e-==Zn2+;正极:Cu2++2e-==Cu和2H++2e-==H2↑
(2)Cu2++Zn==Zn2++Cu;2H++Zn==Zn2++H2↑
0.05 0.05 0.05 0.05
mH2 = 0.1g
高一化学备课组