高一年级化学第二学期期末考试
化 学 试 卷
满分分值:100分 考试时限:100分钟 命题人:江友彬
(可能用到的相对原子质量:H-1、O-16、N-14、K-39、Cu-64)
第I卷:选择题(共45分)
每小题只有一个选项符合题意,每小题3分。
1.下列说法中不正确的是
A.氨是一种易溶、易液化的气体 B.氨分子是三角锥形的极性分子
C.氨能在空气中燃烧 D.氨分子中N-H键是极性键
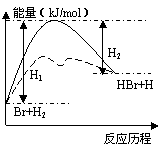
![]() 2.参照反应Br+H2 HBr+H
能量对反应历程(虚线代表使用催化剂)的示意图判断:下列叙述正确的是
2.参照反应Br+H2 HBr+H
能量对反应历程(虚线代表使用催化剂)的示意图判断:下列叙述正确的是
A.正反应放热
B.加入催化剂可以加快正反应速率,降低逆反应速率
C.加入催化剂,降低化学反应的反应热
D.加入催化剂,可以提高活化分子百分数
![]() 3.在一密闭容器中,反应aA(g)
bB(g)达平衡后,保持温度不变,将容积缩小一半,重新达到平衡法,B的浓度为原来的120%,则
3.在一密闭容器中,反应aA(g)
bB(g)达平衡后,保持温度不变,将容积缩小一半,重新达到平衡法,B的浓度为原来的120%,则
A.平衡向正反应方向移动 B.物质A的转化率增大
C.物质B的质量分数增加 D.a<b
4.在一定条件下,PbO2与Cr3+反应,产物是Cr2O72-和Pb2+,则与1molCr3+反应所需PbO2的物质的量为
A.3.0mol B.1.5mol C.1.0mol D.0.75mol
5.在其他条件不变时,若一个反应较难进行,其原因可能是:①参加反应的分子的能量普遍较低;②参加反应的分子能量普遍较高;③单位时间内反应物活化分子有效碰撞次数少;④单位时间内反应物活化分子有效碰撞次数较多;⑤反应物分子中活化分子百分数较小;⑥反应物分子中活化分子百分数较大。其中正确的是
A.①③⑤ B.②④⑥ C.①④⑥ D.②③⑤
![]() 6.甲、乙两容器内都进行A B的反应,甲中A每分钟减少4mol,乙中A每分钟减少2mol,则两容器中的反应速率
6.甲、乙两容器内都进行A B的反应,甲中A每分钟减少4mol,乙中A每分钟减少2mol,则两容器中的反应速率
A.甲快 B.乙快 C.相等 D.无法确定
7.金属加工后的废切削液中含2%~5%的NaNO2,它是一种环境污染物.人们用NH4Cl溶液来处理此废切削液,使NaNO2转化为无毒物质.该反应分两步进行:
第一步:NaNO2+NH4Cl=NaCl+NH4NO2 ,第二步:NH4NO2![]() N2↑+2H2O。下列对第二步反应的叙述中正确的是
N2↑+2H2O。下列对第二步反应的叙述中正确的是
① NH4NO2是氧化剂 ② NH4NO2是还原剂 ③ NH4NO2既是氧化剂又是还原剂
④ 只有氮元素的化合价发生了变化 ⑤ NH4NO2发生了分解反应
A.①③ B.①④ C.②③④ D.③④⑤
8.在一定条件下,将m体积NO和n体积O2同时通入倒立于水中且盛满水的容器内,充分反应后,容器内残留![]() 体积的气体,该气体与空气接触后变为红棕色,则m与n的比值为
体积的气体,该气体与空气接触后变为红棕色,则m与n的比值为
A.3∶8 B.8∶3 C.3∶2. D.2∶3
9.在100 mL 1.0 mol/L的KI溶液中加入2.02 g KNO3固体和适量的稀硫酸,两者恰好完全反应,再往溶液中滴加少量淀粉溶液,溶液呈蓝色,则KNO3被还原的产物可能是
A.N2 B.N2O C.NO D.NO2
10.可逆反应:2NO2![]() 2NO+O2 在密闭容器中反应,达到平衡状态的标志是:
2NO+O2 在密闭容器中反应,达到平衡状态的标志是:
①单位时间内生成n molO2的同时生成2n molNO2
②单位时间内生成n molO2 的同时,生成2n mol NO
③用NO2、NO、O2 的物质的量浓度变化表示的反应速率的比为2 : 2 : 1的状态
④混合气体的颜色不再改变的状态
⑤混合气体的密度不再改变的状态
⑥混合气体的平均相对分子质量不再改变的状态
A.①④⑥ B.①③④ C.②③⑤ D.①②③④⑤⑥
11.在4L密闭容器中充入6mol A气体和5mol B气体,在一定条件下发生反应:
![]() 3 A(g) + B(g) 2 C(g) + x D(g),达到平衡时生成2mol C,经测定c (D)=0.5mol·L-1下列判断正确的是
3 A(g) + B(g) 2 C(g) + x D(g),达到平衡时生成2mol C,经测定c (D)=0.5mol·L-1下列判断正确的是
A.x=1 B.B的转化率为20% .
C.平衡时A的浓度为1.50 mol·L-1
D.达到平衡时,在相同温度下容器内混合气体的压强是反应前的85%
12.在铁与铜的混合物中,加入一定量的稀硝酸,充分反应后,剩余金属m1g,再向其中加入一定量的稀硫酸,充分振荡后,剩余金属m2g,则m1与m2之间的关系为
A.m1一定大于m2 B.m1可能等于m2
C.m1一定等于m2 D.m1可能大于m2
3.试管中盛有白色晶体,检验它是否是铵盐的方法中不可行的是
A.加氢氧化钠溶液,加热,将湿润的酚酞试纸放在管口
B.加氢氧化钠溶液,加热,将蘸有浓盐酸的玻璃棒放在试管口
C.加氢氧化钠溶液,加热,将湿润的红色石蕊试纸放在管口
D.加热,将湿润的红色石蕊试纸放在管口
14.高空大气中 O2的吸收紫外线后可变成臭氧O3,O3可分解:O3 → O2 + O,O3又和大气污染物如超音速飞机排放的NO发生反应:NO +O3→NO2 + O2,NO2 + O→ NO + O2 ,从反应的全过程判断NO的作用是
A.中间产物 B.氧化剂 C.最终产物 D.催化剂
![]()
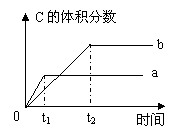 15.如右图所示:反应A(g)+2B(?) 3C(g);在不同条件下反应混合物中C的体积分数和反应过程中所需时间的关系曲线。下列叙述正确的是
15.如右图所示:反应A(g)+2B(?) 3C(g);在不同条件下反应混合物中C的体积分数和反应过程中所需时间的关系曲线。下列叙述正确的是
A.a表示有催化剂,b表示无催化剂
B.若其他条件相同,a比b的温度高,且正反应放热
C.若其他条件相同,a比b的压强小,且B一定不是气体
D.若其他条件相同,a比b的压强大,且B一定是气体
第II卷:非选择题(共55分)
16.(10分)为了证明铜与稀硝酸反应产生一氧化氮,某同学设计了一个实验,其装置如图所示(加热装置和固定装置均已略去),B为一个用金属丝固定的干燥管,内装块状碳酸钙固体;E为一个空的蒸馏烧瓶;F是用于鼓入空气的双连打气球。
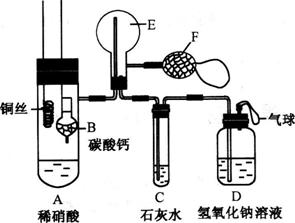 |
(1)实验时,先将B装置下移,使碳酸钙与稀硝酸接触产生气体,当C处产生白色沉淀时,立刻将B装置上提,使之与稀硝酸分离。该组学生设计此步操作的目的为__________________________。
(2)将A中铜丝放入稀硝酸中,给装置A微微加热,在装置A中产生无色气体,其反应的化学方程式为_____________________________________;装置E中开始时出现浅红棕色气体,用F向E中鼓入空气后,可观察到烧瓶E内气体颜色加深,产生上述现象的原因是_____ ________。一段时间后,C中白色沉淀溶解,其原因是________________ _____。
(3)装置D的作用是__________________ __________________。
17.(9分)配平下列氧化还原反应方程式(未写出的物质,填在横线上):
(1) □Cu2S +□HNO3 ——□Cu(NO3)2 + □NO↑+ □H2SO4 + □H2O
(2) □SO32- +□ MnO4- +□H+ ——□Mn2+ +□SO42- + □
(3) □NO3—+□Zn+□OH—+□H2O——□NH3+□Zn(OH)42—
18.(10分)A、B、C、D为常见气体单质。已知:
①A和B可以在放电条件下发生化合反应,其产物还可以与B化合生成红棕色气体;
②C分别与A、B反应生成的两种化合物分子中都含有10个电子;
③C和D反应生成的化合物易溶于水,在其溶液中滴加AgNO3溶液,生成白色沉淀。
请回答:
(1)C和D生成的化合物的电子式是:
(2)上述②中化合物的热稳定性由强到弱的顺序: (填写化学式)
(3)将D通入B、C生成的化合物中,发生反应的化学方程式是: ;
(4)A、C、D所含元素可组成一种离子化合物,该化合物的电子式为: ,实验室检验其中的阳离子的方法是(用离子方程式表示) 。
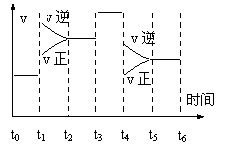 19.(10分)一密闭容器中发生下列反应N2+3H2
19.(10分)一密闭容器中发生下列反应N2+3H2![]() 2NH3;正反应放热。下图是某一时间段中反应速率与反应进程的曲线关系图.回答下列问题:
2NH3;正反应放热。下图是某一时间段中反应速率与反应进程的曲线关系图.回答下列问题:
(1)处于平衡状态的时间段是_______ _____
(2)t1、t3、t4时刻,体系中分别是什么条件发生了变化?__________ 、__________、 ___________。
(3)下列时间段中,氨的百分含量最高的是
A.t0~t1 B.t2~t3 C.t3~t4 D.t5~t6
![]() 20.(8分)将2molSO2和1molO2混合置于体积可变,压强恒定的密闭容器中,在一定温度下发生如下反应:2SO2(g)+O2(g) 2SO3(g);正反应放热。当反应进行到时间t1时达到平衡,测得混合气体总物质的量为2.1mol。试回答下列问题:
20.(8分)将2molSO2和1molO2混合置于体积可变,压强恒定的密闭容器中,在一定温度下发生如下反应:2SO2(g)+O2(g) 2SO3(g);正反应放热。当反应进行到时间t1时达到平衡,测得混合气体总物质的量为2.1mol。试回答下列问题:
(1)反应进行到t1时 ,SO2的体积分数为 。
(2)若在t1时充入一定量的氩气,SO2物质的量将 (填“增大”、“减小”、或“不变”)。
(3)若在t1时升温,重新达到平衡状态,新平衡混合物中气体的总物质的量 2.1mol(填“〈”、“〉”、或“=”),并简单说明原因 。
21.(8分)将32.64g铜与140mL一定浓度的硝酸反应,铜完全溶解产生的NO和NO2混合气体在标准状况下的体积为11.2L。请回答:
(1)被还原的HNO3的物质的量为 mol;标准状况下产生NO的体积为 L。
(2)将产生的气体全部释放后,向溶液中加入VmL a mol/L的NaOH溶液,恰好使溶液中的Cu2+全部转化为沉淀,则原硝酸溶液的物质的量的浓度为 mol/L。
(3)欲使铜与硝酸反应生成的气体在NaOH溶液全部转化为NaNO3,至少需要30%的双氧水 g。