高一年级化学第二学期第三次测试
化 学 试 卷 (化学班)
本卷包括第Ⅰ卷(选择题)和第Ⅱ卷(非选择题),共120分,用时100分钟
可能用到的相对原子质量:H-1 C—12 O-16
第 Ⅰ 卷(选择题 共64分)
一、选择题(本题包括8小题,每小题只有一个选项符合题意。每小题3分,共24分。)
1.环境保护是我国的一项基本国策。污染已成为人类社会面临的重大威胁,下列各词与环境污染无关的是①温室效应 ②赤潮 ③酸雨 ④光化学烟雾 ⑤臭氧空洞 ⑥水俣病
⑦心脏病 ⑧大脖子病 ⑨水华
A.⑦⑧ B.⑦⑧⑨ C. ②⑦⑧⑨ D.②⑤⑦⑧
2.2008奥运会吉样物福娃,其外材为纯羊毛线.内充物为无毒的聚酯纤维(结构简式如下图)。![]() 下列说法中,正确的是
下列说法中,正确的是
A.羊毛与聚酯纤维的化学成分相同 B.聚酯纤维和羊毛在一定条件下均能水解
C.该聚酯纤维的单体为对苯二甲酸和乙醇 D.聚酯纤维和羊毛都属于天然高分子材料
3.市场上有一种加酶洗衣粉,即在洗衣粉中加入少量的碱性蛋白酶,它的催化活性很强,衣服的汗渍、血渍及人体排放的蛋白质油渍遇到它,皆能水解而除去,下列衣料中不能用加酶洗衣粉洗涤的是
①棉织品 ②毛织品 ③腈纶织品 ④蚕丝织品 ⑤涤纶织品 ⑥锦纶织品
A、①②③ B、②④ C、 ③④⑤ D、③④⑥
4.下列各组混合物中,可以用分液漏斗分离的是
A.苯和溴 B.乙酸和乙醇 C.酒精和水 D.溴苯和水
5.电子由3d能级跃迁至4p能级时,可通过光谱仪直接摄取
A.电子的运动轨迹图像 B.原子的吸收光谱
C.电子体积大小的图像 D.原子的发射光谱
6.钠与下列物质反应都能够产生氢气:①H2O;②CH3COOH;③CH3CH2OH。试根据反应现象推断这三种物质电离出H+的难易程度(从难到易的顺序)
A.①②③ B.②③① C.③①② D.②①③
7.现有一瓶乙二醇和丙三醇的混合物,已知它们的性质如下表,据此,将乙二醇和丙三醇互相分离的最佳方法是
| 物质 | 分子式 | 熔点℃ | 沸点℃ | 密度(g/cm3) | 溶解性 |
| 乙二醇 | C2H6O2 | -11.5 | 198 | 1.11 | 易溶于水和乙醇 |
| 丙三醇 | C3H8O3 | 17.9 | 290 | 1.26 | 能跟水、酒精以任意比互溶 |
A.萃取法 B.结晶法 C.分液法 D.分馏法
8.基态碳原子的最外能层的各能级中,电子排布的方式正确的是
A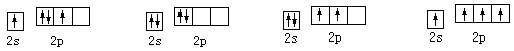 B
C
D
B
C
D
二、选择题:(每小题有一个或两个选项符合题意。每小题4分,共40分。)
9.以下对核外电子运动状况的描述正确的是
A.电子的运动与行星相似,围绕原子核在固定的轨道上高速旋转
B.能量低的电子只能在s轨道上运动,能量高的电子总是在f轨道上运动
C.能层序数越大,s原子轨道的半径越大
D.在同一能级上运动的电子,其运动状态肯定不同
10.下列反应原理中,不符合工业冶炼金属实际情况的是
A.2HgO![]() 2Hg+O2↑
B.2Al+3MnO2
2Hg+O2↑
B.2Al+3MnO2![]() 2Al2O3+3Mn
2Al2O3+3Mn
C.2MgO![]() 2Mg+O2↑ D.4CO+Fe3O4
2Mg+O2↑ D.4CO+Fe3O4![]() 3Fe+4CO2
3Fe+4CO2
11.下列各组物质中,不管它们以何种比例混合,只要总质量一定,充分燃烧后生成的二氧化碳的量不变的是
A.乙炔(C2H2)和苯(C6H6) B.乙醇和丙醇(CH3CH2CH2OH)
C.乙醇和乙醚(C2H5OC2H5) D.甲醛( HCHO)和乙酸
12.糖类、脂肪和蛋白质是维持人体生命活动所必需的三大营养物质。以下叙述正确的是
A.植物油不能使溴的四氯化碳溶液褪色 B.淀粉水解的最终产物是葡萄糖
C.葡萄糖能发生氧化反应、银镜反应和水解反应
D.浓硝酸溅在皮肤上,使皮肤呈黄色是由于浓硝酸和蛋白质发生了颜色反应
13.下列关于乙烯和聚乙烯的叙述不正确的是
A.乙烯常温下是气体,为纯净物;聚乙烯常温下是固体,为混合物
B.乙烯的化学性质比聚乙烯活泼
C.取等质量的乙烯和聚乙烯完全燃烧后,生成的CO2和H2O的质量分别相等
D.乙烯和聚乙烯都能使溴水褪色
14.下列物质可用来鉴别乙酸溶液和乙醇的是
A.稀盐酸 B.石蕊试液 C.氯化钠溶液 D.碳酸钠溶液
15.当镁原子由1s22s22p63s2 →1s22s22p63p2时,以下认识正确的是
A.镁原子由基态转化成激发态,这一过程中吸收能量
B.镁原子由激发态转化成基态,这一过程中释放能量
C.转化后位于p能级上的两个电子处于同一轨道,且自旋方向相同
D.转化后镁原子与硅原子电子层结构相同,化学性质相似
16.构造原理揭示的电子排布能级顺序,实质是各能级能量高低。若以E(nl)表示某能级的能量,以下各式中正确的是
A.E(4s)>E(3s)>E(2s)>E(1s) B.E(3d)>E(4s)>E(3p)>E(3s)
C.E(5s)>E(4f)>E(4s)>E(3d) D.E(5s)>E(4s)>E(4f)>E(3d)
17.以下基态原子的电子排布式不符合构造原理的是
A.1s22s22p63s23p63d74s2 B.1s22s22p63s23p63d54s1
C.1s22s22p63s23p63d104s2 4p1 D.1s22s22p63s23p64s2
18.下列粒子中,电子排布式为1s22s22p63s23p6的有
A.Sc3+ B.Mg2+ C.Cl— D.Br—
| 题号 | 1 | 2 | 3 | 4 | 5 | 6 | 7 | 8 | 9 |
| 答案 | |||||||||
| 题号 | 10 | 11 | 12 | 13 | 14 | 15 | 16 | 17 | 18 |
| 答案 |
第Ⅱ卷(非选择题 共56分)
三、(本题包括3小题,共22分)
19.(3分,多选或少选均不得分)下列有关操作中正确(或能获得成功)的是_________
①为迅速除去乙酸乙酯中少量的乙酸,可加入足量的NaOH溶液并加热。
②向蔗糖溶液中加入3-5滴稀硫酸,水浴加热后,加NaOH溶液至碱性,再加入新制备的Cu(OH)2悬浊液,可以看到有砖红色沉淀生成。
③分离酒精与乙酸的混合物先用NaOH溶液中和,蒸馏;剩余物再与硫酸反应,再蒸馏
④配制银氨溶液时,将稀AgNO3溶液慢慢加到稀氨水中,直至沉淀恰好溶解为止。
⑤用乙醇,冰醋酸和6mol/L的H2SO4共热可制乙酸乙酯
⑥蒸馏石油时,加热一段时间后发现未加碎瓷片,立刻拔开橡皮塞并投入碎瓷片
20.(5分)某化工厂排放的污水中含有Mg2+、Fe3+、Cu2+、Hg2+四种离子。甲、乙、丙三位学生分别设计了从该污水中回收纯净的金属铜的方案。
![]()
![]()
|
|
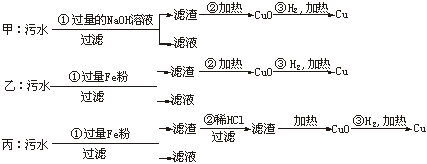
①甲、乙、丙提出的实验方案是否能得到纯净的金属铜?
甲____________,乙_________,丙___________。(填“能”或“不能”)
②在能制得铜的方案中,哪一步操作会导致环境污染?_________________。应增加哪些措施防止污染? 。
21.(14分)实验室用燃烧法测定某氨基酸(CxHyOzNp)的分子组成,取wg该氨基酸放在纯氧中充分燃烧,生成CO2、H2O和N2。现用下图装置进行实验,回答问题:
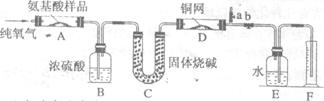 |
(1)实验中止水夹a是关闭的,b是开启的。但是实验开始时,首先要打开a,关闭b,通一段时间的纯氧,这样做的目的是 。
(2)以上装置中需要加热的有(填装置代号) 。操作时应该先点燃 的酒精灯。
(3)装置A中发生反应的化学方程式是 。
(4)实验中测得N2的体积为Vml(已换算为标准状况),为确定此氨基酸的分子式,还需要得到的数据有 (填字母)。
A.生成CO2气体的质量 B.生成水的质量
C.通入氧气的体积 D.该氨基酸的相对分子质量
(5)如果将装置B、C的连接顺序变为C、B,该实验的目的能否达到? ,
理由是 。
四、(本题包括2小题,共21分)
22.(9分)有A、B、C、D、E、F 6种元素,A、B、C、D、E的核电荷数依次增大,且都小于20。其中C、E是金属元素;A和E属同一族,它们原子的最外层电子排布为ns1。B和D也属同一族,它们原子最外层的p能级电子数是s能级电子数的两倍,C原子最外层上电子数等于D原子最外层上电子数的一半。F的离子遇到SCN-变红色。
(1)A是________,B是________,C是________,D是________,E是_________。
(2)写出C元素基态原子的电子排布式_________________________。
(3)用轨道表示式表示D元素原子的电子排布____________________ 。
(4)写出F原子的电子排布式 ,原子结构示意图 。
23.(12分)全球海水中溴的藏量丰富,约占地球溴总藏量的99%,故溴有“海洋元素”之称,海水中溴含量为65mg/L。其工业提取方法有:
(1)空气吹出纯碱吸收法。方法是将氯气通入到富含溴离子的海水中,使溴置换出来,再用空气将溴吹出,用纯碱溶液吸收,最后用硫酸酸化,即可得到溴单质。该方法涉及到的反应有:① (写出离子方程式);②Br2+3CO32—=BrO3-+ 5Br-+3CO2↑;③BrO3-+ 5Br-+6H+=3Br2+3H2O。其中反应②中氧化剂是 ;反应③中氧化剂是 。
(2)空气吹出SO2吸收法。该方法基本同(1),只是将溴吹出后是用SO2来吸收的,使溴转化为氢溴酸,然后再用氯气氧化氢溴酸即得单质溴。写出溴与二氧化硫反应的离子反应方程式:_ ______________ __。
(3)溶剂萃取法。该法是利用单质溴在水中和溶剂中溶解度的不同的原理来进行的。实验室中萃取用到的实验仪器名称是 。下列可以用于海水中溴的萃取试剂的 。
①乙醇 ②四氯化碳 ③硝酸 ④直馏汽油
五、计算题(本题包括2小题,共13分)
24.(6分)1mol链烃A在一定条件下完全裂化成1mol烷烃B和1mol烯烃C,生成的混合气体对H2的相对密度为14.5。
(1)求链烃A的相对分子质量和分子式;
(2)写出链烃A可能有的结构简式。
25.(7分)有机物A由碳、氢、氧三种元素组成。现取2.3 g A与2.8 L氧气(标准状况)在密闭容器中燃烧,燃烧后生成二氧化碳、一氧化碳和水蒸气(假设反应物没有剩余)。将反应生成的气体依次通过浓硫酸和碱石灰,浓硫酸增重2.7 g,碱石灰增重2.2 g。求:
(1)2.3 g A中所含氢原子、碳原子的物质的量各是多少?
(2)通过计算确定该有机物的分子式。
化 学 参 考 答 案
1.A 2.B 3.B 4.D 5.B 6.C 7.D 8.C 9.CD
10.C 11.AD 12.BD 13.D 14.BD 15.A 16.AB 17.B 18.AC
19.③
20.(1)不能;不能;能
(2)丙方案的第③步;应连接冷却回收装置。
21.(1)将装置中的空气排尽
(2)A和D;D
(3)CxHyOz + (x + ![]() )O2
)O2 ![]() x CO2
+
x CO2
+ ![]() H2O +
H2O + ![]() N2
N2
(4)A、B、D
(5)不能,因为烧碱将同时吸收CO2和H2O,使实验结果缺少必要的数据,无法确定该氨基酸的分子式。
22.(1)H O Al S K(写元素名称也可)
(2) 1s22s22p63s23p1
(3)硫的轨道表示式(略)
(4)铁的电子排布式(略);铁的原子结构示意图(略)
23.(1)Cl2+2Br-=2Cl-+Br2 ; Br2; BrO3-
(2)Br2+SO2+2H2O= 4H+ + 2Br- +SO42-;
(3)分液漏斗 ②。
24.(1)58; C4H10
(2)略
25.⑴解:n(O2)= ![]() = 0.125 mol
m(O2)= 0.125 mol×32g·mol-1= 4 g
= 0.125 mol
m(O2)= 0.125 mol×32g·mol-1= 4 g
n(H2O)=![]() = 0.15 mol n(CO2)
=
= 0.15 mol n(CO2)
= ![]() = 0.05 mol
= 0.05 mol
m(CO)= 4 g +2.3 g
- 2.7 g - 2.2 g = 1.4 g n(CO)= ![]() = 0.05 mol
= 0.05 mol
n(H)=2n(H2O)= 0.15 mol×2= 0.3 mol
n(C)= n(CO2) + n(CO) = 0.05 mol + 0.05 mol = 0.1 mol
答:2.3 g A中所含氢原子、碳原子的物质的量分别为0.3 mol 和0.1 mol 。
⑵解:2.3 g A中所含氧原子:
n(O)=(0.05 mol×2 +0.05 mol + 0.15 mol)—0.125 mol×2 = 0.05 mol
n(C)∶n(H)∶n(O) =0.1 mol∶0.3 mol∶0.05 mol = 2∶6∶1
则A 的最简式为 C2H6O
根据价键规则 A 的分子式为 C2H6O 。
答:A 的分子式为 C2H6O 。