高一级化学上册中期考试试题
YCYYCY
本试卷分第Ⅰ卷(选择题)和第Ⅱ卷(非选择题)两部分,共100分,考试时间90分钟
可能用到的相对原子质量是:H-1 C-12 O-16 Na-23
第Ⅰ卷(选择题共54分)
一、选择题(本题包括18小题,每小题3分,共51分。每小题只有一个选项符合题意)
1.下列说法正确的是 ( )
A.伴随能量变化的物质变化都是化学变化
B.反应物的总能量一定大于生成物的总能量
C.化学反应中“贮存”能量的反应为吸热反应
D.需要点燃或加热才能进行的反应一定是吸热反应
2.下列叙述中,正确的是 ( )
A.复分解反应一定都属于非氧化还原反应
B.在氧化还原反应中,非金属单质一定是氧化剂
C.某元素从化合态变为游离态时,该元素一定被还原
D.金属阳离子被还原一定得到金属单质
3.下列物质中属于非电解质的是 ( )
A.NaOH B.CO2 C.H2SO4 D. Fe
4.下列变化需要加入还原剂才能实现的是 ( )
A.NH3 → NH4+ B.Fe2+ → Fe C.H2S → SO2 D.Cl-→Cl2
5.下列反应中水只作还原剂的是 ( )
A.2Na +2H2O = 2NaOH + H2↑ B.2Na2O2 + 2H2O = 4NaOH + O2↑
C.2F2 + 2H2O = 4HF + O2 D.Cl2 + H2O = HCl + HClO
6.下列有关Na和Na+性质的叙述中,正确的是 ( )
A.它们的化学性质相似 B.它们都是银白色金属
C.它们都极易被氧化 D.它们灼烧时都能使火焰呈黄色
7.向酚酞试液中加入过量Na2O2粉末,振荡,下列叙述正确的是 ( )
A.溶液最后变成红色 B.溶液最后褪色
C.溶液最后变成蓝色 D.无明显现象
8.对反应2Na2O2+2CO2=2Na2CO3+ O2的正确说法 ( )
A.是置换反应 B.CO2是氧化剂
C.Na2O2既是氧化剂又是还原剂 D.氧化产物和还原产物都是O2
9.下列反应的离子方程式正确的是 ( )
A.澄清的石灰水跟稀硝酸反应: Ca(OH)2+2H+=Ca2++2H2O
B.氢氧化钡溶液和稀硫酸反应: Ba2++ SO42-= BaSO4↓
C.氢氧化钠溶液中加入少量碳酸氢钙溶液: Ca2++HCO3-+OH-=CaCO3↓+H2O
D.往澄清石灰水通入过量二氧化碳气体: CO2+OH-=HCO3-
10.往某无色透明溶液中加入小块钠完全反应后没有沉淀生成,该溶液中可能大量存在的离子组是 ( )
A.K+、Cu 2+、SO42-、Cl- B.Ba2+、K+、Fe2+、NO3-
C.Na+、NO3-、K+、Cl- D.K+、 Mg2+、Cl-、NO3-
11.为除去括号内的杂质,所选用的试剂或方法不正确的是 ( )
A.Na2C03溶液(NaHC03),选用适量的NaOH溶液
B.NaHC03溶液(Na2C03),应通入过量的C03气体
C.Na202粉末(Na20),将混合物在空气中加热
D.Na2C03溶液(Na2S04),加入适量的Ba(OH)2溶液,过滤
12.下列反应既没有沉淀, 又没有气体生成的是 ( )
A.一小粒钠投入Fe2(SO4)3溶液中 B.碳酸氢钡溶液中加入稀H2S04
C.一小粒钠投入浓盐酸中 D.碳酸氢钠溶液中加入NaOH溶液
13.过量的NaHCO3与Na2O2混合,在密闭容器中充分加热后,最后排除气体,残余物质是
( )
A.NaOH和Na2O2 B.NaHCO3和Na2CO3
C.Na2CO3 D.Na2O
14.在溶液中可以大量共存,加OH-产生沉淀,加H+生成气体的一组离子是 ( )
A.Na+、Cu2+、CO32-、Cl- B.Na+、 Cl-、 HCO3-、Mg2+
C.Cl-、NO3-、K+、 Ca2+ D.NH4+、 K+、 H+、 SO42-
15.下列有关强, 弱电解质叙述正确的是 ( )
A. 所有的酸`, 碱, 盐都是强电解质
B.强电解质溶液的导点能力一定强于弱电解质
C.强酸, 强碱, 大部分盐类是强电解质,弱酸, 弱碱和水都是弱电解质
D.NaOH溶液导电的原因是因为在电流作用下,电离出自由移动的Na+和OH-
16.离子M2O7X-与S2-能在酸性溶液中发生如下反应:M2O7X- +3S2- +14H+==2M3+ +3Sœ +7H2O,则M2O7X-中M的化合价为 ( )
A.+4 B.+5 C.+6 D.+7
17.下列有关碱金属铷(Rb)的叙述中,正确的是
A.铷燃烧的产物只有氧化铷
B.硝酸铷是离子化合物,易溶于水
C.在钠、钾、铷三种单质中,铷的熔点最高
D.氢氧化铷是弱碱
18.在反应3Cl2+6KOH=KClO3+5KCl+3H2O中,氧化剂与还原剂的质量比为 ( )
A.2︰1 B.5︰1 C.1︰2 D.1︰5
第Ⅱ卷(非选择题共46分)
二、填空题(本题包括3小题共15分)
19.(4分)写出下列反应的离子方程式:
①往K2CO3溶液中滴加NaHSO4 溶液
②金属钠与CuSO4溶液反应
20.(6分)标明下列两个氧化还原反应的电子转移的方向和数目:
2 Na2O2 + 2CO2 = 2Na2CO3 + O2 ↑
KH + H2O = KOH + H2 ↑
21.(8分)向饱和的Na2CO3溶液中通入过量的CO2气体有何现象?
原因是:(1) (2) ⑶
三、推断题(本题共8分)
22. 已知D是单质,其他均是常见的化合物,它们之间的转化关系如图所示,其中A的相对分子质量<B的相对分子质量。
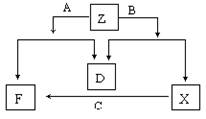
回答下列问题:
⑴ 符合此转化关系的A、B、D的化学式分别是:
A: 、B: 、D: 。
Z: ,
(2)Z中阴阳离子数之比为: 。
⑶ 写出X转化为F的离子方程式: 。
四.实验题(14分)
23.已知某纯碱试样中含有NaCl杂质,为测定试样中纯碱的质量分数,可用右图中的装置进行实验。
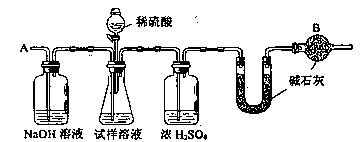
主要实验步骤如下:
① 按图组装仪器,并检验装置的气密性
② 将a g试样放入锥形瓶中,加适量蒸馏水溶解,得到试样溶液
③ 称量盛有碱石灰的U型管的质量,得到b g
④ 从分液漏斗滴入6mol·L—1的硫酸,直到不再产生气体时为止
⑤ 从导管A处缓缓鼓入一定量的空气
⑥ 再次称量盛有碱石灰的U型管的质量,得到c g
⑦ 重复步骤⑤和⑥的操作,直到U型管的质量基本不变,为d g
请填空和回答问题:
⑴在用托盘天平称量样品时,如果天平的指针向右偏转,说明_____________________。
⑵ 装置中干燥管B的作用是___________________________________________。
⑶ 如果将分液漏斗中的硫酸换成浓度相同的盐酸,测试的结果_________________,
如果将试剂瓶中的NaOH溶液换成饱和NaHCO3溶液,测试的结果 (填偏高、偏低或不变)。
⑷ 步骤⑤的目的是__________________________________________。
⑸ 步骤⑦的目的是__________________________________________。
⑹ 试样中纯碱的质量分数的计算式为___________________。
五、计算题( 6分)
24.在一密闭的容器中盛有H2 和 O2 混合气体共7.2克向其中加入足量的Na2O2固体粉末并用电火花点燃气体,充分反应后Na2O2固体质量增重1.6克,回答:
① 容器中还有何气体? 质量为多少?
②生成新物质是什么? 质量为多少?
答题卷
化 学
第一卷
一.选择题:(54分)
| 题号 | 1 | 2 | 3 | 4 | 5 | 6 | 7 | 8 | 9 |
|
| c | a | b | b | c | d | b | c | d |
| 题号 | 10 | 11 | 12 | 13 | 14 | 15 | 16 | 17 | 18 |
| 答案 | c | d | d | c | b | c | d | b | b |
第二卷
二.填空题:(18分)
19.(4分) ① CO32- + 2H+ = CO2↑
+ H2 O
② 2Na + Cu2+ + 2H2O = Cu(OH)2↓ + H2 + 2Na+
20 .(6分)
2 Na2O2 + CO2 = 2 Na2CO3 + O2 ↑ (电子转移数目为2e- )
KH + H2O = KOH + H2 ↑ (电子转移数目为e- )
21.(8分) 现象: 有碳酸氢钠晶体析出
原因是:(1) 原溶剂减少 (2) 新溶质质量增加 ⑶ 碳酸氢钠溶解度小于碳酸钠
三: 推断题: (8分)
22 .回答下列问题:
⑴
A: H2O 、B: CO2 、D: O2 。
Z: Na2O2 ,
(2)Z中阴阳离子数之比为: 1:2 。
⑶ 写出X转化为F的离子方程式: Ca2+ +CO32- = CaCO3↓ 或 Ba2+ +CO32- = BaCO3 ↓ 。
四: 实验题;(14分)
. 23.
⑴ 药品取少了
⑵ 防止U型管中的碱石灰吸收空气中的二氧化碳和水
⑶ 测试的结果 偏大,
测试的结果 偏大 (填偏高、偏低或不变)。
⑷ 步骤⑤的目的是 把锥形瓶中的 CO2赶入U型管中被完全吸收
⑸ 步骤⑦的目的是 减少实验误差
⑹ 试样中纯碱的质量分数的计算式为 53(d – b)
22a
五 .计算题(本题只有一小题共6分)
24 .
⑴ O2 5.6克
⑵ NaOH 64克