高一级化学上学期半期考试题
本试卷分第Ⅰ卷(选择题)和第Ⅱ卷(非选择题)两部分,共100分,时间 90分钟。
可能用到的相对原子质量是:H-1 C-12 N-14 O-16 Na-23 Cl-35.5 Cu-64
第Ⅰ卷(选择题共48分)
一、选择题(本题包括6小题,每小题3分,共18分。每小题只有一个选项符合题意)
1.下列物质不属于“城市空气质量日报”报道的是 ( )
A.二氧化硫 B.二氧化氮 C.二氧化碳 D.悬浮颗粒
2.下列叙述中,正确的是 ( )
A.复分解反应一定都属于非氧化还原反应
B.在氧化还原反应中,非金属单质一定是氧化剂
C.某元素从化合态变为游离态时,该元素一定被还原
D.金属阳离子被还原一定得到金属单质
3.下列物质中属于非电解质的是 ( )
A.NaOH B.CO2 C.H2SO4 D. Fe
4.下列变化需要加入还原剂才能实现的是 ( )
A.NH3 → NH4+ B.Fe2+ → Fe C.H2S → SO2 D.Cl-→Cl2
5.下列反应中水只作还原剂的是 ( )
A.2Na +2H2O = 2NaOH + H2↑ B.2Na2O2 + 2H2O = 4NaOH + O2↑
C.2F2 + 2H2O = 4HF + O2 D.Cl2 + H2O = HCl + HClO
6.下列有关Na和Na+性质的叙述中,正确的是 ( )
A.它们的化学性质相似 B.它们都是银白色金属
C.它们都极易被氧化 D.它们灼烧时都能使火焰呈黄色
二、选择.(本题包括10小题,每小题3分,共30分。每小题有一个或两个选项符合题意.只有一个正确选项的,多选不给分.有两个正确选项的,选对一个给1分,选错一个该小题不给分).
7.向酚酞试液中加入过量Na2O2粉末,振荡,下列叙述正确的是 ( )
A.溶液最后变成红色 B.溶液最后褪色
C.有气体生成 D.无明显现象
8.下列比较不正确的是 ( )
A.稳定性:Na2O﹤Na2O2 B.溶解性:NaHCO3﹥Na2CO3
C.碱性:LiOH﹥KOH D.还原性:K﹥Na
9.根据下列三个反应的化学方程式:I2 + SO2 + 2H2O === H2SO4 + 2HI,2FeCl2 + Cl2 === 2FeCl3,2FeCl3 + 2HI === 2FeCl2 + 2HCl + I2 , 有关物质的还原性依次减弱的顺序( )
A.I-、Fe2+、Cl-、SO2 B.Cl-、Fe2+、SO2、I-
C.Fe2+、I-、Cl-、SO2 D.SO2、I-、Fe2+、Cl-
10.下列反应的离子方程式正确的是 ( )
A.澄清的石灰水跟稀硝酸反应: Ca(OH)2+2H+=Ca2++2H2O
B.氢氧化钡溶液和稀硫酸反应: Ba2++ SO42-= BaSO4↓
C.氢氧化钠溶液中加入过量碳酸氢钙溶液: Ca2++HCO3-+OH-=CaCO3↓+H2O
D.往澄清石灰水通入过量二氧化碳气体: CO2+OH-=HCO3-
11.往某无色透明溶液中加入小块钠完全反应后没有沉淀生成,该溶液中可能大量存在的离子组是 ( )
A.K+、Cu 2+、SO42-、Cl- B.Ba2+、K+、Fe2+、NO3-
C.Na+、NO3-、K+、Cl- D.K+、 Mg2+、Cl-、NO3-
12.过量的NaHCO3与Na2O2混合,在密闭容器中充分加热后,最后排除气体,残余物质是
( )
A.NaOH和Na2O2 B.NaHCO3和Na2CO3
C.Na2CO3 D.Na2O
13.在溶液中可以大量共存,加OH-产生沉淀,加H+生成气体的一组离子是 ( )
A.Na+、Cu2+、CO32-、Cl- B.Na+、 Cl-、 HCO3-、Mg2+
C.Cl-、NO3-、K+、 Ca2+ D.NH4+、 K+、 H+、 SO42-
14.在反应3Cl2+6KOH=KClO3+5KCl+3H2O中,氧化剂与还原剂的质量比为 ( )
A.2︰1 B.5︰1 C.1︰2 D.1︰5
15.离子M2O7X-与S2-能在酸性溶液中发生如下反应:M2O7X- +3S2- +14H+==2M3+ +3Sœ +7H2O,则M2O7X-中M的化合价为 ( )
A.+4 B.+5 C.+6 D.+7
16.已知2FeCl3+Cu=2FeCl2+CuCl2,如果向盛有FeCl3溶液的烧杯中同时加入铁粉和铜粉,反应结束后下列结果不可能出现的是 ( )
A.烧杯中有铜无铁 B.烧杯中有铁无铜
C.烧杯中铁、铜都有 D.烧杯中铁、铜都无
第Ⅰ卷选择题答案(共48分)
| 1 | 2 | 3 | 4 | 5 | 6 | 7 | 8 | 9 | 10 | 11 | 12 | 13 | 14 | 15 | 16 |
第Ⅱ卷(非选择题共52分)
三.填空题(46分)
17.(9分)
(1)碱金属元素包括_____,_____,_____,_____,Cs,Fr,其单质的熔点随此顺序逐渐_____。
(2)某化学反应中,反应物的总能量为E1,生成物的总能量为E2。若E1﹤E2,则该反应为____热反应。一般中和反应是_____热反应,其反应实质的离子方程式为______________。
18.(10分) 标出下列反应中的电子转移及数目,并回答有关问题
(1)KClO3+6HCl=KCl+3Cl2↑+H2O
氧化产物是___________,还原产物是__________,其质量比为___________。
(2)3Cu+8HNO3=3Cu(NO3)2+2NO↑+4H2O
反应中硝酸表现________性和__________性,若有64g铜被氧化,则氧化剂的质量为_______。
19.(8分)写出下列反应的离子方程式:
①碳酸氢钠和盐酸反应:___________________________
②往装有Na2CO3溶液的试管中逐滴滴入少量HCl溶液:__________________________
③往NaHSO4溶液中滴加少量Ba(OH)2 溶液反应:_____________________________
 ④少量的碳酸氢钠与Ba(OH)2 溶液反应:___________________________________ 20.(12分)根据下列实验装置回答:
④少量的碳酸氢钠与Ba(OH)2 溶液反应:___________________________________ 20.(12分)根据下列实验装置回答:
NaCHO3
C Na2O2
A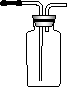
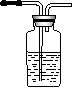
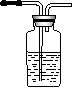
浓硫酸 石灰水
B D E
(1) A中反应的化学方程式为:_____________________________________
(2) B中浓硫酸的作用是____________________________________________
(3) C中的现象是__________________________________________________
化学方程式为:________________________________________________
(4) D中反应的离子方程式为: _____________________________________
(5) E中收集的气体是______________________________________________
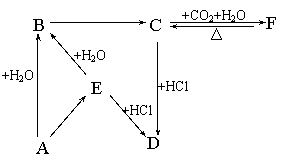 21.(7分)下图所示各项变化的未知数中均含有钠元素,E为淡黄色粉末,据此回答下列问题:
21.(7分)下图所示各项变化的未知数中均含有钠元素,E为淡黄色粉末,据此回答下列问题:
(1)D在水中的电离方程式为:_________________________________
(2)写出E→B的离子方程式:__________________________________
(3)在B→C的变化中所得C的溶液往往不纯,其中的杂质(不包括水)可能是 ___,
主要原因是 ;还可能是 ,主要原因是 。
四.计算题(本题包括1小题共 6分)
22.(6分)有一表面被部分氧化的金属钠,质量为10.8g,投入到100g水中完全反应后,收集到0.2g氢气,试计算:
(1) 被氧化的金属钠的质量是多少克?
(2) 未被氧化前金属钠的质量?
(3) 反应后所得溶质的质量分数?
参考答案
一、选择题
1、C 2、A 3、B 4、B 5、C 6、D
二、选择题
7、BC 8、BC 9、D 10、CD 11、C
12、C 13、B 14、B 15、C 16、B
三.填空题
17.Li,Na,K,Rb。降低,吸热,放热。(各1分)H++OH-=H2O(2分)
18.(1)5e-,Cl2,Cl2,(各1分)5:1(2分)(2)6 e-,酸性,氧化性,(各1分)42g(2分)
19.(1)HCO3-+H+=H2O+CO2↑ (2)CO32-+H+=HCO3-
(3)2H++2SO42-+Ba2++2OH-=BaSO4↓+2H2O (4)HCO3-+Ba2++OH-=BaCO3↓+H2O(各2分)
20.(1)2NaCHO3=Na2CO3+H2O+CO2↑,(2)吸水作用(3)淡黄色粉未变成白色2Na2O2+CO2=NaCO3+O2(4)CO2+Ca2++2OH-=CaCO3↓+H2O((5)O2(各2分)
21、(1) NaCl=Na++Cl-(1分)(2)2Na2O2+H2O=4Na++4OH-+O2↑(2分)
(3)NaOH,CO2通入量不够;NaHCO3,CO2通入过量。(各1分)
四计算题
22、答案:(1)4.6g (2)9.2g (3)14.5%(各2分)
解析:设被氧化的钠xg,未被氧化的钠yg
2Na+2H2O =2NaOH+H2↑
2×23 80 2
x 8g 0.2g
x=4.6g
m Na2O2=10.8g-4.6g=6.2g
4Na + O2=2Na2O
4×23 2×62
Na2O + H2O=2NaOH
62 2×40
6.2g 8g
y=4.6g
4.6g+4.6g=9.2g
![]()