高一级化学上学期学月考试卷
注意事项:
1.本试卷分第Ⅰ卷(选择题)和第Ⅱ卷(非选择题)两部分,共四大题24个小题。考试时间90分钟,满分100分。
2.认真分析,仔细审题;答题要求规范,卷面整洁。
3.务必在第II卷在指定的地方写姓名、考生号,并必须用黑色字迹的钢笔或签字笔作答,选择题答案写在题号后答题框内. 非选择题答案直接写在题卷上.( 即各题目指定区域内相应位置上),只交第Ⅱ卷。
4.可能用到的相对原子质量:H:1 N:14 O:16
第I卷(选择题,共48分)
一、 选择题(本题包含16个小题,每小题3分,共48分。每小题只有一个选项符合题意。)
1、“化学——人类进步的关键”是( )在美国化学会成立100周年大会上的讲话。
A、爱因斯坦 B、诺贝尔 C、居里夫人 D、西博格
2、从硫元素的化合价态上判断,下列物质中的硫元素不能表现氧化性的是 ( )
A.Na2S B. S C. SO2 D. H2SO4
3、下列化学方程式中电子转移不正确的是 ( D )
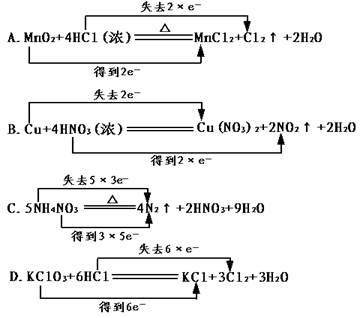
4、下列实验操作中正确的是 ( )
A.给试管内的液体加热时,试管口对着人
B.用天平称量时,把称量物放在左盘,砝码放在右盘
C.把烧杯放在铁圈上直接加热
D.用胶头滴管滴加液体时,滴管触及容器内壁
5、下列有关四种基本反应类型与氧化还原反应关系的说法中正确的是 ( )
A.化合反应一定是氧化还原反应
B.分解反应一定不是氧化还原反应
C.置换反应一定是氧化还原反应
D.复分解反应不一定是氧化还原反应
6、能正确表示下列化学反应的离子方程式的是 ( )
A、碳酸钙溶于稀醋酸中CaCO3+2H+=Ca2++H2O+CO2
B、澄清的石灰水与稀盐酸反应Ca(OH)2 + 2H+= Ca2+ + 2H2O
C、铜片插入硝酸银溶液中Cu + Ag+= Cu2+ + Ag
D、氢氧化钡溶液与盐酸的反应OH-+H+= H2O
7、氧化还原反应在生产、生活中具有广泛的用途。下列生产、生活中的事例不属于氧化还原反应的是 ( )
A.金属冶炼 B.燃放鞭炮 C.点制豆腐 D.食物腐败
8、下面三个方法都可以用来制氯气:
①4HCl(浓)+MnO2![]() MnCl2+Cl2↑+2H2O
MnCl2+Cl2↑+2H2O
② 4HCl(g)+O2![]() 2Cl2+2H2O(g)
2Cl2+2H2O(g)
③2KMnO4+16HCl(浓) =2KCl+2MnCl2+5Cl2↑+8H2O
则三种氧化剂由强到弱的顺序是 ( )
A.O2 MnO2 KMnO4 B.KMnO4 MnO2 O2
C.MnO2 KMnO4 O2 D.O2 KMnO4 MnO2
9、下列化学变化中,需加入氧化剂才能实现的是 ( )
A.C→CO2 B.CO2→ CO
C.CuO→Cu D.H2SO4→BaSO4
10、下列说法正确的是( )
A、液态HCl、固体NaCl均不导电,所以HCl、NaCl均是非电解质
B、蔗糖、酒精在水溶液或熔化时均不导电,所以它们是非电解质
C、酸、碱、盐三类物质的共同点是都含有氧元素、都能溶于水
D、NH3、CO2的水溶液均导电,所以NH3、CO2均是电解质
11、下列水溶液中的各组离子因为发生氧化还原反应而不能大量共存的是( )
A.Na+、Ba2+、Cl-、SO42-
B. Ca2+、HCO3-、C1-、K+
C.MnO4-、K+、I-、H+
D. H+ 、Cl- 、Na+ 、CO32-
12、下列反应既属于氧化还原反应,又是吸热反应的是
A. 铝片与稀硫酸的反应 B. Ba(OH)2·8H2O与NH4Cl的反应
C. 灼热的碳与CO2的反应 D. 甲烷在氧气中燃烧
13.氧化还原反应发生在同种元素之间的是 ( )
A.2H2S+SO2=3S+2H2O
B.Zn+2HCl=ZnCl2+H2↑
C. H2+CuO=Cu +H2O
D.2H2O ![]() 2H2↑+O2↑
2H2↑+O2↑
14、下列说法不正确的是( )。
① 化石燃料在任何条件下都能充分燃烧
② 化石燃料在燃烧过程中能产生污染环境的CO、S02等有害气体
③ 直接燃烧煤不如将煤进行深加工后再燃烧的效果好
④ 固体煤变为气体燃料后,燃烧效率更低
A.①④ B.②③④ C.②③ D.①③④
15、已知M2O7x-+3S2-+14H+=2M3++3S↓+7H2O,则M2O7x-中的M的化合价为 ( )
A.+2 B.+3 C.+4 D.+6
16、如图,在一只盛有饱和Ca(HCO3)2溶液的烧杯中漂浮着一个木块。小心地向烧杯中滴加石灰水,至二者恰好反应时停止滴加,静置一段时间,可以观察到的现象是( )
A.滴加过程中有气泡产生
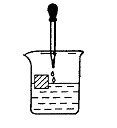 B.滴加过程中无白色沉淀产生
B.滴加过程中无白色沉淀产生
C.静置后,木块浸入水中的体积比滴加石灰水前增大
D.静置后,木块浸入水中的体积比滴加石灰水前减小
 答题卷
答题卷
高一年级化学试卷成绩统计表(考生不要填写)
| 题 号 | 一 | 二 | 三 | 四 | 总 分 | ||||
| 17 | 18 | 19 | 20 | 21 | 22 | 23 | |||
| 得分 |
|
|
|
|
|
|
|
|
|
第I卷答题栏(选择题,共48分)
| 题号 | 1 | 2 | 3 | 4 | 5 | 6 | 7 | 8 |
| 答案 |
|
|
|
|
|
|
|
|
| 题号 | 9 | 10 | 11 | 12 | 13 | 14 | 15 | 16 |
| 答案 |
|
|
|
|
|
|
|
|
第Ⅱ卷(非选择题,共52分)
二、填空题(本题包括4小题,共31分).
17、A.(4分)现有以下列物质:①NaCl晶体 ②液态SO2 ③液态的醋酸
④汞 ⑤BaSO4固体 ⑥纯蔗糖(C12H22O11) ⑦酒精(C2H5OH)
⑧KOH溶液 ⑨熔化的KNO3, 请回答下列问题(填序号):
⑴以上能导电的是 ;
⑵以上属电解质的是 ;
⑶属强电解质的是 ;
⑷以上属非电解质的是 。
B、(3分) 在进行有关燃料充分燃烧的条件讨论时,有两种意见:甲同学 认为:空气越多越好,乙同学认识:空气足量即可.你认为上述哪一位同学的意见是不正确的?理由是什么?答_____________ ,
________________________________________________________________
C、(3分)一切化学反应除了有质量的变化外,还伴随着 的变化,它们分别遵循 定律和 定律。能量变化通常主要
表现为 的变化,即 或者 。
18、(7分)用双线桥表示下列反应中得失电子的情况,并按要求回答:
3FeO + 10HNO3 == 3Fe(NO3)3 + NO↑ + 5H2O.
(1) 元素被氧化, 是氧化剂。
(2) 是氧化产物, 发生氧化反应。
(3)在参加反应的盐酸中,起氧化剂(被还原)作用的HNO3与起酸性作用的
HNO3的质量比为 。
(4)用双线桥标明电子转移的方向和数目。(标在题目方程式上)
19、(8分)按要求回答:(每空2分,共8分)
(1)写出硝酸的电离方程式。 。
(2)硝酸银溶液跟盐酸混和的离子方程式 。
(3)加热氯酸钾制氧气化学方程式为 。
(4)写出符合离子方程式Ba2++SO42- =BaSO4↓的一个化学方程式是 。
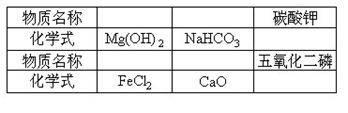 20、填写下表:
20、填写下表:
(每空1分,共6分)
三、实验与分析(本题包括1小题,共12分)
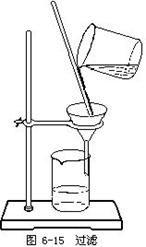
21.(12分)粗食盐中混有不溶于水的泥沙,通过下述实验除去泥沙等杂质,使粗食盐得到提纯。

(1)在上述仪器中,可用于粗盐提纯实验的有___________________________________(填写仪器名称);
(2)按要求填写粗盐提纯实验的主要操作步骤及其相关内容:
|
↓
| |
↓
| |
(3)过滤器(如图)的制作方法是将一张圆形滤纸先折成半圆,再折成四等份,然后打开成圆锥形,把其尖端朝下放入漏斗.过滤操作时应做到“一贴二低三靠”,即滤纸应紧贴________,滤纸边缘应低于__________.滤纸液面应低于________,滤液应靠________引流,玻璃棒应靠_______层滤纸的一边,漏斗的下端的管口应紧靠________.
(4)某同学在同等实验条件下,所得产品的产量(产率)明显比其他同学少,请你帮他分析可能的原因(写出两条即可)①___________________________________;
②___________________________________________。
四、推断题(本题包括2小题,共9分)
22、(7分)处于同一条小河的上、中、下游的甲、乙、丙三座工厂,每厂向小河排放的废液里含有CuCl2、Ca(OH)2、HCl中的一种。环保局对污水监测发现:(1)甲处水域呈乳白色(2)乙处水域变成蓝色浑浊(3)丙处水域由浑浊变清。
问:(1)甲、乙、丙各厂排放的废液 分别是什么?
甲是________、乙是________、丙是________
(2)请写出乙处、丙处水域所起反应的离子方程式。
23、(2分) 已知W2、X2、Y2、Z2四种物质的氧化能力Z2>X2>W2>Y2,判断下列氧化还原反应能发生的是
![]()
![]() A、2W-+Z2 2 z-+W2
B、2X-+ W 2 2W-+ X2
A、2W-+Z2 2 z-+W2
B、2X-+ W 2 2W-+ X2
![]()
![]() C、2X-+Y2 2Y-+X2 D、2Z-+X2
2X-+Z2
C、2X-+Y2 2Y-+X2 D、2Z-+X2
2X-+Z2
高一年级化学参考答案
一、选择题(本题包含16个小题,每小题3分,共48分。)
DADBC DCB ; ABCCA ADC
16、设M2O7x-中M的化合价为n,根据化合价升降守恒
![]()
2(n-3)=3×2
n=6。D
二、(本题包括4小题,共31分)
17.(10分)
A(4分)(1)④⑧⑨(2) ①③⑤⑨(3) ①⑤⑨ (4)②⑥⑦ (各1分)
B (3分)甲不对(1分).
因为过量空气会带走部分热量,同样会造成资源的浪费.(2分)
C、(3分)能量;质量守恒定律;能量守恒定律;热量 ;放热;吸热 。
(每空0.5分,共2分)
18、(7分)(1)铁 HNO3 (2)Fe(NO3)3 ,FeO
(3)的质量比为 1:9 。(每空1分,共5分)
(4)用双线桥标明电
 失去3×e-
失去3×e-
3FeO + 10HNO3 ==3Fe(NO3)3 +NO↑ + 5H2O(每空2分,共2分)
得到3e-
19.(8分)(1)( HNO3=H![]() +
+![]() ) (2)( Ag++Cl—=AgCl↓) (3)2KClO3
) (2)( Ag++Cl—=AgCl↓) (3)2KClO3![]() 2KCl+3O2↑
2KCl+3O2↑
(4) Na2SO4+BaCl2===2NaCl+3BaSO4↓(其他合理答案均可)(每空2分,共8分)
 20、(每空1分,共6分)
20、(每空1分,共6分)
三、(本题包括2小题,共12分)
21、(12分)
(1)酒精灯、漏斗、烧杯、蒸发皿(错1个得1分,错3个不得分,共2分)
(2)
|
① 将固体研碎、用玻璃棒搅拌(或加热)
|
② 引流
|
③ (每空1分,共5分)
(3)、漏斗 漏斗边缘 滤纸边缘 玻璃棒 三 烧杯(每空0.5分,共3分)
(4)(答案合理均给分)示例:
①药品未完全溶解就开始过滤
②蒸发时有溅出 (每空1分,共2分)
四、(本题包括2小题,共9分)
22、(7分)(1)甲:Ca(OH)2 ; 乙 :CuCl2 ; 丙 :HCl (每空1分,共3分)
(2)Cu2++2OH-=Cu(OH)2↓
Cu(OH)2+2H+=Cu2++2H2O(每空2分,共4分)
23、(2分) A、
| |
