高一级化学上学期期末复习试题一
本试卷分第Ⅰ卷(选择题)和第Ⅱ卷(非选择题)两部分,第Ⅰ卷(第1题至20题),
第Ⅱ卷(第21题至27题)。共110分,考试时间100分钟。
可能用到的相对原子质量:H-1 C-12 O-16 S-32 Na-23 Si-28 Al-27 Cl-35.5
第Ⅰ卷(共60分)
一、选择题(本题包括 18小题,每小题只有一个选项符合题意,每小题3分,共60分)
1、保护环境已成为当前和未来全球性的重大课题之一,为了消除对大气污染,有科学家提出利用太阳能促使燃料循环使用的构想,使一些燃烧产物重新变成燃料,下列物质中有可能合成的燃料是:
A.CO2 B.CH3OH C.N2 D.H2O
2、你认为减少酸雨产生的途径①减少煤作燃料 ②造高工厂烟囱 ③燃料脱硫
④在已酸化的土壤中加石灰 ⑤开发新能源,可采取的措施是:
A.①②③ B.②③④⑤ C.①③⑤ D.①③④⑤
3、根据人们的实践经验,一般说来,极性分子组成的溶质易溶于极性分子组成的溶剂,非极性分子组成的溶质易溶于非极性分子组成的溶剂,根据这个实践经验,下列叙述不正确的是:
A.氯化氢易溶于水,不易溶于苯(非极性分子)
B.碘易溶于CCl4(非极性分子),也易溶于水
C.食盐易溶于水,不易溶于汽油(非极性分子的混合物)
D.硫难溶于水,易溶于CS2液体中
4、下列各组溶液中,用括号内的试剂及物质间相互反应不能鉴别的一组是:
A.Ba(OH)2 AgNO3 NaCl Mg(NO3)2 (FeCl3溶液)
B.NaNO3 NaHCO3 (NH4)2SO3 Na2SiO3 (H2SO4溶液)
C.NH4Br K2CO3 NaI CaCl2 (AgNO3溶液)
D.(NH4)4PO4 NaBr CuSO4 AlCl3(KOH溶液)
5、下列叙述正确的是
A.检验某溶液中是否含有CO32-,加入CaCl2,观察有白色沉淀生成,证明有CO32-存在
B.鉴别NO2和溴蒸气可用AgNO3溶液,不可以用淀粉KI溶液
C.向H3PO4溶液中加入AgNO3溶液,观察有黄色沉淀生成,证明有PO43-存在
D.检验溶液中是否含NH4+,可加入足量NaOH溶液,加热,再用红色湿润的石蕊试纸伸入试管内检验是否变蓝。
6、下列离子方程式正确的是:
①硝酸与铁反应:Fe + 2H+ = Fe2+ + H2↑
②H2S通入大量NaOH溶液中:OH-+H2S = HS-+H2O
③Ba(OH)2溶液中通入足量的SO2气体:Ba2++SO2+H2O = BaSO3↓+H2O
④实验室制硫化氢:S2-+2H+= H2S↑
⑤铁跟盐酸反应:2Fe+6H+ = 2Fe3++3H2↑
⑥碳酸钙与醋酸反应:CaCO3+2CH3COOH = Ca2++2CH3COO-+H2O+CO2↑
A.①②③④⑤ B.⑥ C.②③④ D.①④⑥
7、在短周期元素中,原子的核电荷数、核外电子层数、每层所容纳的电子数、族序数均为偶数的有:
A.2种 B.3种 C.4种 D.8种
8、某溶液既能溶解Al(OH)3,又能溶解H2SiO3,在该溶液中可以大量共存的离子组是:
A.K+、Na+、HCO![]() 、NO
、NO![]()
B.Na+、SO![]() 、Cl-、ClO-
、Cl-、ClO-
C.H+、Mg2+、SO![]() 、NO
、NO![]()
D.Ag+、K+、NO![]() 、Na+
、Na+
9、鉴别纯碱、石灰石、芒硝、石膏四种固体物质,应选用:
A.硝酸 B. NaOH溶液
C.水、盐酸 D.BaCl2和HNO3
10、已知硫酸铅难溶于水也难溶于酸,却可溶于醋酸铵(NH4Ac,Ac–表示醋酸根离子)溶液形成无色溶液,其化学方程式是:PbSO4+2NH4Ac = Pb(Ac)2+(NH4)2SO4当在Pb(Ac)2)溶液中通入H2S气体时,有黑色沉淀PbS生成。表示这种黑色PbS生成的反应的方程式正确的是:
A.Pb(Ac)2+H2S=PbS↓+2HAc(醋酸)
B.Pb2++H2S = PbS↓+2H+
C.Pb2++2Ac-+H2S = PbS↓+2HAc
D.Pb2++2Ac-+2H++S2-=PbS↓+2HAc
11、核内中子数为N的R2–离子,质量数为A,则n克它的氢化物中所含质子数的物质的量是:
A.![]() (A–N+2)mol B.
(A–N+2)mol B.![]() (A–N+4)mol
(A–N+4)mol
C.(A–N+2)mol D.![]() (A–N+6)mol
(A–N+6)mol
12、下列递变规律正确的是:
A.按Na+、Mg2+、Al3+的顺序离子半径依次增大
B.按N、O、F的顺序最高价氧化物的水化物酸性依次增强
C.按N、P、As、Sb、Bi的顺序单质的熔沸点依次升高
D.按P3-、S2-、C1-的顺序还原性依次减弱
13、0.05 mol某单质与0.8 g硫在一定条件下完全反应,该单质可能是:
A.H2 B.O2
C.K D.Zn
14、等体积硫酸铝、硫酸锌、硫酸钠溶液分别与足量的氯化钡溶液反应。若生成
的硫酸钡沉淀的质量比为1:2:3,则三种硫酸盐溶液的物质的量浓度比为:
A.1:2:3 B.1:6:9
C.1:3:3 D.1:3:6
15、将4.6克金属钠和2.1克硅粉同时投入适量的水中,在标准状况下产生H2的体积是:
A.11.2 L B.5.6 L C.2.8 L D.1.4 L
16、R、W、X、Y、Z为原子序数依次递增的同一短周期元素,下列说法一定正确的是(m、
n均为正整数):
A.若R(OH)n为强碱,则W(OH)n+1也为强碱
B.若HnXOm为强酸,则Y是活泼非金属元素
C.若Y的最低化合价为-2,则Z的最高正化合价为+6
D.若X的最高正化合价为+5,则五种元素都是非金属元素
17、从某些性质看,(CN)2和Cl2,NH3和H2O,NH4+与H3O+,NH2-与OH-,各组内两两相似。由此判断,下列方程式所表示的反应中正确的是:
① (CN)2+2OH-=CN-+OCN-+H2O ② NH4Cl+NaNH2=NaCl+2NH3↑
![]() ③ CaO+2NH4Cl=CaCl2+2NH3↑+H2O
④ 2Na+2NH3=2NaNH2+H2↑
③ CaO+2NH4Cl=CaCl2+2NH3↑+H2O
④ 2Na+2NH3=2NaNH2+H2↑
A.只有①② B.①④ C.只有③④ D.都正确
18、利用化学变化的递变规律,常可对某些物质的化学性质作出合理的推测,请判断下列各
项的推测合理的是:
A.从NH4Cl受热分解生成气体,冷却后完全恢复原状,推测NH4I受热分解生成气体,冷却后也完全恢复原状
B.从二氧化硫通入Ba (OH)2溶液能产生白色沉淀的事实,推测二氧化硫通入BaCl2溶液也能产生白色沉淀
C.从2CO2 + 2Na2O2 = 2Na2CO3 + O2的反应,推测二氧化硫也一定能发生反应:
2SO2 + 2Na2O2 = 2NaSO3 + O2
D.从红热的铜丝能在氯气中燃烧,推测红热的铁丝也能在氯气中燃烧
19、含8.0g NaOH的溶液中通入一定量H2S气体后,将所得溶液小心蒸干,称得无水物7.9 g,该该无水物中一定含有的物质是:
A.Na2S B.NaHS
C.Na2S和NaHS D.NaOH和NaHS
20、经实验测得,把等物质的量浓度的NaOH溶液逐滴滴入CuSO4溶液中,两者体积比为1.5∶1时(残存在溶液中的Cu2+极少,可认为全部转入沉淀中),所生成沉淀的化学式是:
A.Cu(OH)2 B.Cu(OH)2·CuSO4
C.2Cu(OH)2·CuSO4 D.3Cu(OH)2·CuSO4
第Ⅰ卷答题卷
| 1 | 2 | 3 | 4 | 5 | 6 | 7 | 8 | 9 | 10 |
|
|
|
|
|
|
|
|
|
|
|
| 11 | 12 | 13 | 14 | 15 | 16 | 17 | 18 | 19 | 20 |
|
|
|
|
|
|
|
|
|
|
|
第Ⅱ卷(非选择题,共50分)
二、境空题(共42分)
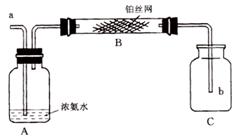 21、(10分)氨在铂作催化剂的条件下,能与氧气反应生成NO和H2O。用图示装置做氨催化氧化的实验,回答下列问题。
21、(10分)氨在铂作催化剂的条件下,能与氧气反应生成NO和H2O。用图示装置做氨催化氧化的实验,回答下列问题。
(1)如何获得氨与空气的混合气体,并使混合气体通过B管?
(2)开始实验时要给B管加热,待反应开始以后撤去酒精灯,铂丝网继续保持红热。请写出B管中发生的化学方程式:
(3)①如果氨在B管中已经反应完,C瓶中发生的现象是
②如果氨在B管中未反应完,C瓶中发生的现象是
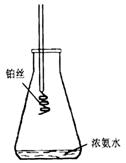 (4)采用下图装置做氨催化氧化的实验也能得到很好的效果:请简要说明实验的操作过程:
(4)采用下图装置做氨催化氧化的实验也能得到很好的效果:请简要说明实验的操作过程:
22、(4分) 向NaOH和酚酞的混合液中滴入双氧水,红色消失,有的人认为是H2O2具有弱酸性,将NaOH溶液中和而使红色消失,有的人却认为是H2O2具有具有强氧化性,将有色物质氧化成无色物质而永久性褪色。
(1)、(2分)请设计一个简单的实验证明谁的观点正确:
(2)、(2分)含ClO- 的溶液和H2O2发生激烈反应,产生能量较高的氧分子,它立即转变为普通氧分子,向反应后的溶液中加入酸化的硝酸银溶液,有白色沉淀,则ClO-与H2O2反应的离子方程式是________________________________________________________________
23、(12分)三种短周期元素X、Y、Z ,它们的最外层电子数与电子层数之比分别为1:1、2:1、3:1。
(1)只根据上述信息就能够确定的元素是____________。(选填X、Y、Z和对应的元素符号。)
(2)由Y、Z构成的气态化合物W能使澄清石灰水变浑浊,W的分子式可能是(用元素符号填写):______________________________________________________
(3)若X的最高价氧化物的水化物能够跟Y的最高价氧化物的水化物按物质的量之比2:3反应,则X是____________________,Y是___________________,该反应的离子方程式为;______________________________________________________________。(用元素符号填写)
(4)由X、Y、Z三种元素组成的离子化合物,其化学式包含6个原子,这种化合物的化学式是___________________________________(用元素符号填写)。
24、(10分)下图是部分短周期元素的单质及其化合物的转化关系图(有关反应的条件及生成的H2O已略去),已知:(a)A、B、C、D是非金属单质,其中B、C、D在常温常压下是气体。(b)反应①②是化工生产中的重要反应。(c)化合物E是形成酸雨的污染物之一,化合物K是常用的氮肥。(d)化合物L具有漂白性,可由Cl2与NaOH溶液反应而制得。(e)化合物J由两种元素组成,其相对分子质量为32。
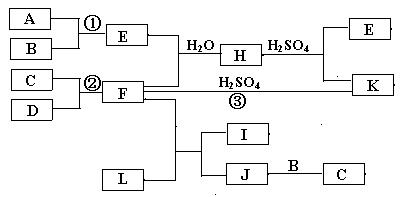
请按要求填空:
⑴反应③的化学方程式_____________________________________________________。
⑵C的结构式_________________________;H的化学式_____________________。
⑶L的溶液与化合物E反应的离子方程式________________________________________。
⑷化合物J的化学式____________________。
25、(6分)已知硫粉跟亚硫酸钠溶液共热可制得硫代硫酸钠(Na2S2O3)。现以硫化亚铁为主要原料,按下图制取硫代硫酸钠。图中的A、B、C和D是硫单质或硫的化合物,其它不含硫的反应产物已被略去,各步反应可以添加必要的试剂。请填写下列空白:
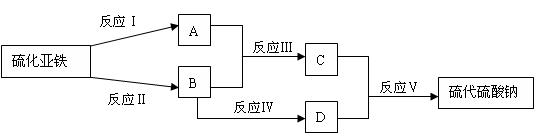
(1)反应(Ⅰ)的离子方程式是:______________________________________________
(2)物质B的分子式是: ________________物质A的电子式:_________________
三、计算题(8分)
26、(3分)现有一硅钢片(只含Fe、Si),将其投入足量盐酸中或足量NaOH溶液中,放出的气体质量相同,则硅钢片中硅与铁的物质的量之比为_______________
27、(5分)已知氮的氧化物跟NaOH溶液发生的反应如下:
![]() ;
;![]()
现有m mol的![]() 和n molNO组成的混合气体,用NaOH溶液将其完全吸收(无气体剩余),现有浓度为
和n molNO组成的混合气体,用NaOH溶液将其完全吸收(无气体剩余),现有浓度为![]() 的NaOH溶液,求需此NaOH溶液的体积是多少?
的NaOH溶液,求需此NaOH溶液的体积是多少?
参考答案
第Ⅰ卷答题卷
| 1 | 2 | 3 | 4 | 5 | 6 | 7 | 8 | 9 | 10 |
| B | C | B | C | B | B | C | B | C | A |
| 11 | 12 | 13 | 14 | 15 | 16 | 17 | 18 | 19 | 20 |
| A | D | C | B | B | B | D | D | A | D |
21、(1)从a处通人空气……………………………………………………………………(2分)
(2)4NH3 + 5O2= 4NO + 6H2O
(3)①出现红棕色气体…………………………………………………………………(2分)
②出现白烟…………………………………………………………………………(2分)
(4)先加热一会儿锥形瓶(或摇动锥形瓶),使氨挥发,然后将烧至红热的铂丝伸进锥形瓶。
………………………………………………………………………………………(4分)
22、(1)取褪色后的混合溶液,在加入过量的NaOH溶液,若红色复现,则是H2O2的弱酸性所至,反之则强氧化性。
(2)Cl- + H2O2 = Cl- + O2↑ + H2O
23、(1)Z、O
(2)CO2、SO2
(3)Al、S、Al(OH)3 + 3H+ = Al3+ + 3H2O
(4)BeSO4
24、(1)2NH3 + H2SO4 =(NH4)2SO4
(2)N≡N;(NH4)2SO3或NH4HSO3
(3)ClO- + SO2 + 2OH- = SO42- + Cl- + H2O
(4)N2H4
25、(1)FeS + 2H+ = Fe2+ + H2S↑
(2)SO2 、略
26、1:2
27、(m+n)/aL