高一级化学上学期期末复习试题二
本试卷分第Ⅰ卷(选择题)和第Ⅱ卷(非选择题)两部分,第Ⅰ卷(第1题至20题),第Ⅱ卷(第21题至26题)。共110分,考试时间100分钟。
可能用到的相对原子质量:H-1 C-12 O-16 S-32 Na-23 Si-28 Al-27 Cl-35.5
第Ⅰ卷(共60分)
一、选择题(本题包括 18小题,每小题只有一个选项符合题意,每小题3分,共60分)
1、光纤通信是一种新型通信技术,目前长距离光纤通信系统已投入使用,光纤通信用的光学纤维是下列哪种物质经特殊工艺制成的:
A.石墨 B.石英
C.锗 D.硅
2、下列化学用语正确是:
A.Cl–的示意图 B.OH-的电子式 C.NH4+的结构式 D.HClO的电子式

![]()
![]()
![]()
3、下列各组物质性质变化正确的是:
A.酸性:HClO4>H2SO4>H2CO3>H3PO4
B.稳定性:H2S>HCl>HBr>HI
C.粒子半径:Br–>K+>S2–>S
D.还原性:S2–>Br->Cl–>F–
4、能正确表示下列反应的离子方程式是:
A.小苏打溶液与醋酸反应:HCO3– + H+ = CO2↑ + H2O
B.过量的CO2使澄清的石灰水最终仍保持澄清:OH- + CO2 = HCO![]()
C.碳酸氢钙溶液中加入过量的烧碱溶液:Ca2++HCO3-+OH-= CaCO3↓+H2O
D.硫化亚铁与稀硝酸反应:FeS+2H+ = Fe2++H2S↑
5、将0.1mol铁粉和0.06mol硫粉均匀混合后,铺在石棉网上加热,完全反应后,将残渣全部放入过量稀硫酸中充分反应,结果所产生的气体体积在标准状况下明显少于2.24L,其主要原因是:
A.部分铁被空气中的氧气所氧化
B.铁未完全反应
C.硫燃烧变成了SO2
D.铁与硫反应
6、向已呈红色的某酚酞溶液中通入适量的SO2,结果红色消失,其原因是:
A.SO2 具有漂白性
B.SO2 具有还原性
C.SO2 具有氧化性
D.SO2的水溶液呈酸性
7、将SO2通入BaCl2溶液至饱和,未见沉淀生成,继续通入另一种气体仍无沉淀生成,则通入的气体可能是:
A.CO2 B.NH3 C.Cl2 D.H2S
8、已知98%的浓H2SO4的浓度为18.4mol·L-1,则49%的硫酸溶液的浓度为:
A.9.2 mol·L-1
B.大于9.2 mol·L-1
C.小于9.2 mol·L-1
D.不能确定
10、在氧气中灼烧0.485g某金属硫化物,使硫全部转化为SO2,SO2再转化为硫酸、这些硫酸可用20mL0.5mol/L的NaOH溶液完全中和,则原硫化物可能是:
A.FeS2 B.ZnS C.FeS D.Cu2S
11、某溶液中加入氯化钡溶液生成白色沉淀,再加稀硝酸沉淀不溶解也无气体逸出,则这种溶液中:
A.一定含有SO![]()
B.一定含有Ag+
C.一定含有SO![]() 或SO
或SO![]() 或Ag+
或Ag+
D.SO![]() 或Ag+至少存在一种
或Ag+至少存在一种
12、下列说法不正确的有:
A.硅酸盐工业使用的每一种原料中都必须含有硅
B.水泥、普通玻璃都是混合物
C.生产水泥、玻璃都需用石灰石
D.用纯净的石英可制成石英玻璃,它的膨胀系数小,常用来制造耐高温的化学仪器
13、在一定温度下,向55.3g蒸馏水中加入一定质量的无水Na2SO3粉末,充分搅拌后过滤,得到60g滤液和一定质量的Na2SO3·7H2O晶体。若此温度下Na2SO3的溶解度为20g,那么析出的Na2SO3·7H2O晶体的质量是:
A.15.3g B.10.6g
C.10g D.5.3g
14、某溶液中可能含有Na+、Fe2+、Br–、CO32–、I–、SO32–六种离子中的几种。(1)在该溶液中滴加足量氯水后,有气泡产生、溶液呈橙黄色;(2)向呈橙黄色的溶液中加入BaCl2溶液时无沉淀生成;(3)橙黄色溶液不能使淀粉溶液变蓝。根据上述实验事实推断在该溶液中肯定都存在的离子组是:
A.Na+、Br-、CO32-
B.Na+、SO32-、I-
C.Fe2+、I-、SO32-
D.Fe2+、CO32-、Br-
15、下列物质中既能跟稀H2SO4反应, 又能跟氢氧化钠溶液反应的是:
①NaHCO3 ②Al2O3 ③Al(OH)3 ④(NH4)2S ⑤ Al
A.②③④ B.①②③⑤
C.①③④ D.全部
16、标况下nLNH3溶于水中得到密度为![]() 的氨水AL,则此氨水的质量分数为:
的氨水AL,则此氨水的质量分数为:
A.![]()
B.![]()
C.![]()
D.![]()
17、将充满NO2和O2混合气体的量筒倒立于盛有水的水槽中,经过一段时间后,水上升到量筒体积的一半处停止了,则剩余气体的成份是:
A.NO2 B.NO
C.O2 D.NO或O2
18、a mol金属单质M和含2.5a mol HNO3的稀溶液恰好完全反应,氧化产物是M(NO3)2,则还原产物可能是:
A.NO2 B.NO
C.N2 D.NH4NO3
19、由Zn、Fe、Al、Mg四种金属中的两种组成的混合物13g,与足量的盐酸反应产生的氢气在标况下为11.2升,则混合物可能的组成是:
A.Zn和Fe B.Fe和Al
C.Al和Mg D.Mg和Fe
20、设阿伏加德常数为NA。则下列说法正确的是:
A.标准状况下,22.4 L五氧化二氮中含有氧原子数为5 NA
B.标准状况下,0.3mol二氧化硫中含有氧原子数为0.3NA
C.常温下,5.6g Fe与硝酸反应,失去的电子数一定为0.3NA
D.常温常压下,8g甲烷中含有的极性共价键为2NA
第Ⅰ卷答题卷
| 1 | 2 | 3 | 4 | 5 | 6 | 7 | 8 | 9 | 10 |
|
|
|
|
|
|
|
|
|
|
|
| 11 | 12 | 13 | 14 | 15 | 16 | 17 | 18 | 19 | 20 |
|
|
|
|
|
|
|
|
|
|
|
第Ⅱ卷(非选择题,共50分)
二、境空题(共40分)
21、(5分)元素的种类决定于 ,元素是否有同位素取决于 _____ ,元素的化学性质主要决定于 ,在原子序数1-18号的元素中酸性最强的含氧酸是(填化学式,下同) ,最稳定的气态氢化物是 ___ 。
22、(11分)有X、Y、Z、W四种短周期元素,原子序数依次增大,其核电荷数总和为38,Y元素原子最外层电子数占核外电子总数的![]() ;W元素原子最外层电子比同周期Z元素多5个电子,W和Y不属于同一主族。
;W元素原子最外层电子比同周期Z元素多5个电子,W和Y不属于同一主族。
(1)写出元素符号:X ,Y ,Z ,W ;
(2)Z、W两种元素最高价氧化物对应水化物反应的方程式是
。
23、(12分)有两个实验小组的同学为探究过氧化钠与二氧化硫的反应都用如下图所示的实验装置进行实验,通入SO2气体,将带余烬的木条插入试管C中,木条复燃。
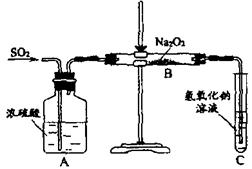
试回答下列问题:
(1) 第1小组同学认为反应生成了Na2SO3和O2,该反应的化学方程式为:
(2)请设计一种实验方案证明Na2O2和SO2反应生成的白色固体中含Na2SO3。
(3)第2小组同学认为Na2O2和SO2反应除了生成Na2SO3和O2外,还有Na2SO4生成,为检验是否有Na2SO4生成,他们设计了如下方案
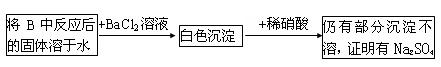
上述方案是否合理: 请简要说明理由
①
②
24、(12分) 由短周期元素组成单质A、B、C和甲、乙、丙、丁四种化合物有如图所示转化关系,且已知C为密度最小的气体,甲为非电解质。根据以上转化关系回答下列问题:
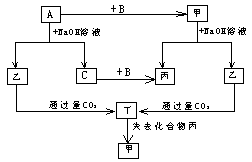 |
(1)单质A只可能是 ____________________,
因为: ___________ 。
(2)写出下列反应方程式:
a: A与NaOH溶液反应:
b: 乙与过量的CO2反应:
三、计算题(10分)
25、常温下有一种混合气体,可能由He、H2、O2、N2、NH3、NO、HCl、CO2等气体中的几种所组成,取200mL混合气体进行如下实验:①将混合气体通过浓H2SO4体积减少40mL②余下气体通过Na2O2固体容器中充分反应后,体积又减少40mL③将②剩余气体引燃后,再冷却到室温,气体体积减少105mL④最后的剩余气体中有5mL是O2⑤整个反应过程中气体颜色无变化。试回答
(1)混合气体一定有哪些气体?各占多少mL? ___________________________________
(2)混合气体中一定没有哪些气体 _____________________________________________
(3)混合气体中可能有哪些气体 _______________________________________________。
26、某化肥厂用![]() 制备
制备![]() 。已知:由
。已知:由![]() 制
制![]() 的产率是96%,
的产率是96%,![]() 制
制![]() 产率是92%,
产率是92%,![]() 跟
跟![]() 反应生成
反应生成![]() ,则制
,则制![]() 所用去的氨气的质量占总耗氨质量分数是多少?(不考虑生产中其它损耗)
所用去的氨气的质量占总耗氨质量分数是多少?(不考虑生产中其它损耗)
参考答案
一、选择题(每题3分)
第Ⅰ卷答题卷
| 1 | 2 | 3 | 4 | 5 | 6 | 7 | 8 | 9 | 10 |
| B | B | D | B | A | D | A | C |
| B |
| 11 | 12 | 13 | 14 | 15 | 16 | 17 | 18 | 19 | 20 |
| D | A | B | A | D | B | C | D | BD | D |
二、填空题
21、(每空1分) 核电荷数(质子数) 中子数 最外层电子数 HClO4 HF
22、(1)(每空2分) X:H Y:O Z:Mg W:Cl
(2)(3分) Mg(OH)2+2HClO4=Mg(ClO4)2+2H2O
23、(1)(3分) 2Na2O2+2SO2=2Na2SO3+O2
(2)(3分) 取反应后的固体配成溶液,滴加稀盐酸看能否产生使湿润品红试纸褪色的气体。
(3)(每空2分) 不合理
①HNO3氧化性强,会把Na2SO3氧化为Na2SO4。
②溶于水时,若Na2O2剩余,也能把Na2SO3氧化为Na2SO4。
24、(每空3分)
(1) 硅。 与NaOH溶液反应产H2的有Al和Si,而Al2O3为电解质,SiO2为非电解质。
(2)a: Si+2NaOH+H2O=Na2SiO3+2H2↑(或Si+2NaOH+4H2O=Na2SiO3+2H2↑+3H2O)
Na2SiO3+2CO2+3H2O=2NaHCO3+H4SiO4↓
25、(1)H2-70ml NH3-40ml CO2-80ml
(2)O2、NO、HCl
(3)He、N2
26、53.1%