高一级化学上学期期末模拟试题
考试时间:100分钟 总分:110分
第Ⅰ卷 选择题(共54 分)
可能用到的相对原子质量:H-1 C-12 S-32 O-16 Cl-35.5 Ba-137 Na-23
一、选择题(每小题只有一个选项符合题意,每小题 3分共54 分)
1、核裂变产生的核能可以用于发电,
![]() 是一种常用的核燃料,下列说法错误的是:
是一种常用的核燃料,下列说法错误的是:
A.![]() 相对原子质量为235 B.
相对原子质量为235 B.![]() 中中子数比质子数多51
中中子数比质子数多51
C.![]() 与
与![]() 的质量比约为235:12 D.
的质量比约为235:12 D.![]() 与
与![]() 属于同一种元素
属于同一种元素
2、物质的性质决定了物质保存的方法。下列药品的保存方法合理且与氧气有关的是:
A.液溴用水液封后密封在棕色试剂瓶中
B.烧碱、过氧化钠等物质密封保存在试剂瓶中
C.氯水盛放在棕色细口瓶中
D.少量金属钠保存在煤油中
3、下列状态的物质,既能导电又属于电解质的是:
A.MgCl2晶体 B.NaCl溶液
C.液态氯化氢 D.熔融的KOH
4、精确配制一定物质的量浓度的NaOH溶液,下面实验操作正确的是:
A.称量时,将NaOH固体直接放在天平托盘上面的纸上
B.将称好的NaOH固体放入容量瓶中,加入少量水溶液
C.在烧杯中溶解NaOH固体后,立即将溶液注入容量瓶中
D.将烧杯中已冷却的NaOH溶液注入未经干燥的容量瓶中
5、原子在化学反应中,会发生变化的是:
A. 质子数 B. 中子数
C. 电子数 D. 质量数
6、根据以下反应:①H2S + I2 = 2H+ + 2I-+S↓; ②H2SO3 + 2H2S = 3S ↓+ 3H2O;
③2 I-+Br2 = 2I2 + 2Br-;④H2SO3 + I2 + H2O = H2SO4 + HI 试确定Br-、I-、H2S和H2SO3的还原性由强到弱的顺序:
A. H2S > H2SO3 > I-> Br-
B. Br-> I- > H2SO3 > H2S
C. H2SO3 > H2S > Br-> I-
D. I-> Br-> H2S > H2SO3
7、巳知某无色溶液中存在较多的H+、SO42-,则该溶液中还可能大量存在的离子组是:
A.Na+、HCO3-、Cl- B.Cu2+、Fe3+、I-
C.Al3+、K+、NO3- D.Ca2+、Cl-、I-
8、离子方程式可以使我们更好的了解化学反应的本质。下列离子方程式中正确的是:
A.等体积、等物质的量浓度的KHSO4溶液与Ba(OH)2溶液反应:
Ba2++2OH-+2H++SO42-=BaSO4↓+2H2O
B.在氢氟酸中加入过量氢氧化钾:H++OH-=H2O
C.在氯化铁溶液中加入过量氨水:Fe3++3OH-=Fe(OH)3↓
D.在碳酸氢钙溶液中加入少量苛性钾溶液
Ca2++HCO3-+OH-=CaCO3↓+H2O
9、以NA表示阿伏加德罗常数,下列说法正确的是:
A.53 g碳酸钠中含NA个CO32-
B.0.1 mol OH-含NA个电子
C.1.8 g重水(D2O)中含NA个中子
D.标准状况下,11.2 L臭氧中含NA个氧原子
10、同温同压下,氦气、氢气和氨气的体积比为3:2:1,则其原子个数比为:
A.1:2:3 B.4:3:3 C.3:4:4 D.3:2:1
11、把4.48L CO2 通过一定量的固体过氧化钠后收集到3.36L气体(标准状况),则这3.36L气体的质量是:
A.3.8g B.5.6 g C.4.8 g D.6.0 g
12、把实验室制取的氯气,先通入洗气瓶后再通入盛有干燥红色布条的容器M,布条不褪色;如果将氯气直接通入M容器,布条褪色,则洗气瓶所盛的试剂不可能是:
A.浓硫酸 B.氯化钠溶液 C.氢氧化钠溶液 D.碘化钾溶液
13、比较是化学学习中的一种重要方法。下列各组比较中错误的是:
A.在相同温度下的溶解度:Na2CO3>NaHCO3
B.热稳定性:Na2CO3>NaHCO3>H2CO3
C.表示Na2CO3和NaHCO3分别与Ba(OH)2溶液反应的离子方程式相同
 D.等质量的Na2CO3和NaHCO3分别与等浓度的HCl溶液完全反应,后者消耗的盐酸少
D.等质量的Na2CO3和NaHCO3分别与等浓度的HCl溶液完全反应,后者消耗的盐酸少
14.如图装置可以用来发生、洗涤、干燥、收集(不考虑尾气处理)气体。该装置可用于
A.锌和盐酸生成氢气
B.二氧化锰和浓盐酸生成氯气
C.碳酸钙和盐酸生成二氧化碳
D.氯化钠和浓硫酸生成氯化氢
15、下列是某研究性学习小组对离子方程式xR2++ yH++ O2= mR3++nH2O的分析研究,在各种不同的说法中错误的是:
A.可以根据电荷守恒,得出x与y的和一定等于m的结论
B.可以根据原子守恒,得出x和m的数值一定相等的结论
C.可以根据氧化还原反应中电子得失守恒,得出x的值等于4的结论
D.可以根据氧化还原反应中各种关系,得出R2+是还原剂、O2是氧化剂、 R3+是氧化产物、H2O是还原产物的结论
16、常温下将0.1mol下列物质分别投入90g水中充分混合:①Na ②NaOH ③![]() ④
④![]() ,所得溶液中OH-物质的量浓度大小排列顺序正确的是:
,所得溶液中OH-物质的量浓度大小排列顺序正确的是:
A.③>④>②>①
B.④>③>②>①
C.①>④=③>②
D.③=④>①>②
17、被称为万能还原剂的NaBH4溶于水并和水反应:NaBH4+2H2O=NaBO2+4H2↑(NaBH4中H元素为-1价),对于此反应,下列说法中正确的是:
A.NaBH4既是氧化剂又是还原剂
B. NaBH4是还原剂,H2O是氧化剂
C.硼元素被氧化,氢元素被还原
D. 被氧化的元素与被还原的元素质量比为2:1
18、Na2CO3和NaHCO3混合物100g,加热至质量不再减少时,冷却后称重,剩余固体质量为93.8g,则原混合物中碳酸钠的质量分数为:
A.95.6% B.83.2% C.91.6% D.87.2%
 一、选择题(3×18=54分)
一、选择题(3×18=54分)
| 题号 | 1 | 2 | 3 | 4 | 5 | 6 | 7 | 8 | 9 |
| 答案 |
|
|
|
|
|
|
|
|
|
| 题号 | 10 | 11 | 12 | 13 | 14 | 15 | 16 | 17 | 18 |
| 答案 |
|
|
|
|
|
|
|
|
|
第Ⅱ卷 非选择题(共56分)
二、填空题(本题5小题,共34分)
19、(6分)在下列物质 ① NaCl;②氨水;③ SO3;④ 铁片;⑤ 石墨;⑥ HF;⑦ 醋酸;⑧ 碳酸钙中,属于电解质的是 (填编号,下同),属于强电解质的是 ,既不属于电解质又不属于非电解质的是 。
20、(4分)配平并用“双线桥”表示下列氧化还原反应中电子转移的方向和总数:
____Zn + _____HNO3 ( 稀 ) → _____Zn(NO3)2 + _____NH4NO3 + _____H2O
21、(6分)在某澄清溶液中,可能存在下述几种离子:H+、K+、Ba2+、SO42-、I-、CO32-。取该溶液进行下述实验:⑴ 用PH试纸检验,该溶液呈强酸性;⑵ 取部分溶液,滴入几滴氯水,再加入少量四氯化碳,振荡静置,四氯化碳层呈紫色;⑶ 另取部分溶液,逐滴加入NaOH 溶液,使溶液由酸性逐渐变成碱性,然后再入 Na2CO3 溶液,有白色沉淀生成。根据上述实验现象,推断原溶液中肯定存在的离子是 ,肯定不存在的离子是 ,可能存在的离子是 。
22、(8分)在盛有NaI、AgNO3、CaCl2、K2CO3、HBr的已失去标签的五种无色溶液的试剂瓶上,分别贴上①②③④⑤的编号,使它们两两反应,产生的现象在下表中列出。请在表中的结论格内,填写这些编号所代表的物质的名称。
| ① | ② | ③ | ④ | ⑤ | |
| ① | — | 无色↑ | 白色↓ | 白色↓ | 无 |
| ② | 无色↑ | — | 无 | 浅黄↓ | 无 |
| ③ | 白色↓ | 无 | — | 白色↓ | 无 |
| ④ | 白色↓ | 浅黄↓ | 白色↓ | — | 黄色↓ |
| ⑤ | 无 | 无 | 无 | 黄色↓ | — |
| 结论 |
23、(10分)由A、B两种常见化合物组成的混合物,其焰色反应均呈黄色,相互转化关系如图(其他物质均已略去)。
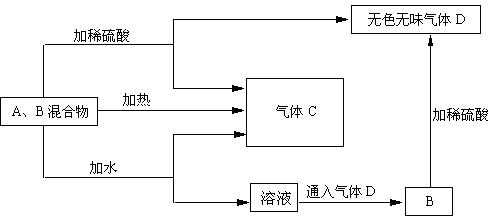
回答下列问题:
⑴ 化学式:A 、B 、D
⑵ B加热产生D的化学方程式: 。
⑶ A、B加热后,若只得到一种固体化合物,则A与B的物质的量之比的最大值为
(填数字)
三、实验题(本题共12分).
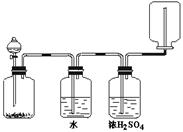
24、为了证明干燥氯气无漂白性以及卤素氧化性的强弱,可先制取氯气再进行性质实验。下图为实验所提供的仪器和药品,据此回答下列问题:
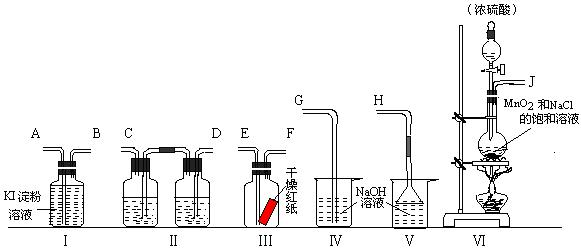
⑴ (2分)各仪器装置连接的顺序为(填接口序号)
接 、 接 、 接 、 接 。
⑵ (4分)装置Ⅰ中的现象是 。装置Ⅰ中发生反应的离子方程式为 ;
⑶ (6分)装置Ⅵ中发生反应的化学方程式为:
仪器Ⅱ中分别加入的试剂为 和 。(按先后顺序填)
四、计算题(共10分)
25、取100mL的Na2CO3和Na2SO4混合溶液,加入适量Ba(OH)2溶液100 mL后,恰好完全反应,过滤、干燥后得到14.51g白色沉淀和滤液,再用过量稀硝酸处理沉淀,最后减少到4.66g,并有气体放出。计算:
(1)(2分)原混合液中Na2SO4的物质的量浓度为 mol ·L-1。
(2)(2分)产生的气体在标准状况下的体积为 L。
(3)(6分)过滤出沉淀后,计算所得滤液的物质的量浓度(设反应后溶液的体积为200mL)。
参考答案
一、选择题(3×18=54分)
| 题号 | 1 | 2 | 3 | 4 | 5 | 6 | 7 | 8 | 9 |
| 答案 | A | D | D | D | C | A | C | D | B |
| 题号 | 10 | 11 | 12 | 13 | 14 | 15 | 16 | 17 | 18 |
| 答案 | C | D | B | C | A | A | D | B | B |
19、①⑥⑦⑧;①⑧;②④⑤
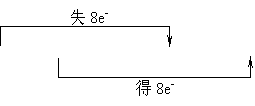 |
20、4Zn + 10HNO3 ( 稀 ) = 4 Zn(NO3)2 +1 NH4NO3 +3 H2O
21、H+、Ba2+、I¯ ;CO32-、SO42- ;K+
22、①~⑤分别为碳酸钾、氢溴酸、氯化钙、硝酸银、碘化钠。
23、⑴A、Na2O2 B、NaHCO3 D、CO2
![]()
⑶1:2 (Na2O2与H2O反应生成NaOH ,NaOH再吸收CO2生成Na2CO3 )
24、⑴J、D、C、E、F、A、B、G
⑵ 溶液变蓝;Cl2 + 2I - = 2Cl - + I2
![]() ⑶;2 NaCl + MnO2 + 3H2SO4 2NaHSO4 + MnSO4
+ Cl2↑+ 2H2O
⑶;2 NaCl + MnO2 + 3H2SO4 2NaHSO4 + MnSO4
+ Cl2↑+ 2H2O
饱和食盐水和浓硫酸
25、(1)0.2 (2)1.12
(3)所得滤液溶质为NaOH。根据Na元素守恒得
n(NaOH)=2×[n(Na2SO4)+n(Na2CO3)]
=2×[![]() ]
]
=0.14mol
故 c(NaOH)=![]() =0.7mol/L
=0.7mol/L