高一年级化学第一学期期中联考试题
化 学 试 题
本试卷分第Ⅰ卷(选择题)和第Ⅱ卷(非选择题)两部分,满分100分,考试时间100分钟。
可能用到的相对原子质量:
H:1 O:16 Na:23 Cl:35.5 C:12 Cu:64 Fe:56 K:39 N:14
第Ⅰ卷(选择题,共55分)
一、选择题(每小题只有1个选项符合题意,每小题2分,共10分)
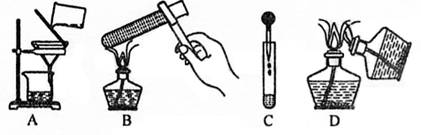
1.下图所示实验操作中正确的是 ( )
|
2.下列说法正确的是 ( )
A.摩尔是表示物质粒子数量的单位 B.物质的量可理解为物质的质量
C.摩尔是表示物质的量的单位 D.摩尔是七个基本物理量之一
3.下列对于焰色反应的叙述正确的是 ( )
A.只有金属单质才有焰色反应
B.只有金属化合物才有焰色反应
C.用焰色反应可以判断某些金属元素的存在
D.观察焰色反应必须透过蓝色钴玻璃
4.氢氧化铁胶体稳定存在的主要原因是 ( )
A.胶粒直径小于1nm B.胶粒作布郎运动
C.胶粒带正电荷 D.胶粒不能通过半透膜
5.下列反应不属于氧化还原反应的是 ( )
A.CuSO4 + 2NaOH = Cu (OH)2↓+ Na2SO4
B.CuSO4 + Zn = ZnSO4 + Cu
C.Cu + 2H2SO4 (浓) = CuSO4 + SO2↑+ H2O
![]()
D.2Cu + O2 2CuO
二、选择题(每小题有1—2个选项符合题意,每小题3分,共45分)
6.下列物质体积一定是22.4L的是 ( )
A.1 mol 水蒸气 B.17g氨
C.标准状况下44g二氧化碳 D.0℃2×105Pa压强时2g氢气
7.下列物质中含有自由移动的Cl-离子的是 ( )
A.KclO3溶液 B.MgCl2溶液 C.液态HCl D.熔融的NaCl
8.用固体NaOH配制物质的量浓度溶液时,下列操作会导致溶液浓度偏高的是 ( )
A.在烧杯中溶解时,有少量液体溅出
B.样品中含有少量NaCl杂质
C.容量瓶使用前未干燥
D.定容时俯视容量瓶刻度线
9.选择一种溶剂将碘水中的碘萃取出来,这种溶剂应具备的性质是 ( )
A.易溶于水,且不与碘发生化学反应
B.不溶于水,且比水更易使碘溶解
C.不溶于水,且密度必须比水大
D.不溶于水,且密度必须比水小
10.在溶液中能大量共存,加入OH-有沉淀析出,加入H+能放出气体的是 ( )
A.Na+、H+、NO-3、Cl- B.K+、H+、Cl-、SO42-
C.Ca2+、NO3-、HCO3-、Cl- D.Fe3+、NH4+、SCN-、Cl-
11.有NaCl、FeCl2、FeCl3、MgCl2、AlCl3五种溶液,只用一种试剂就可把它们鉴别开来,这种试剂是 ( )
A.盐酸 B.烧碱溶液 C.氨水 D.KSCN溶液
12.根据反应:2H2S + O2 = 2S↓+ 2H2O;4Nal + O2 + 2H2SO4 = 2l2 + 2Na2SO4 + 2H2O;
Na2S + I2 = 2Nal + S↓,判断下列物质的氧化性强弱,正确的是 ( )
A.O2 > I2 >S B.H2S > NaI > H2O
C.S > I2 > O2 D.H2O > Nal > H2S
13.已知反应3Cl2 + 6NaOH = 5NaCl + NaClO3 + 3H2O,对该反应的下列说法不正确的是
( )
A.Cl2既是氧化剂,又是还原剂
B.反应中转移的电子数为6e-
C.氧化剂与还原剂的质量比是1 :5
D.被氧化的氯原子数与被还原的氯原子数之比是1 :5
14.将2.3g风钠溶于水中,如果使溶液中的Na+和H2O的物质的量之比1 :100,则需水的质量为 ( )
A.100g B.180.2g C.181.8g D.182.5g
15.为检验某FeCl2溶液是否变质,可向溶液试样中加入 ( )
A.NaOH溶液 B.铁片 C.KSCN溶液 D.石蕊试液
16.Na2CO3固体中可能含有杂质K2CO3、NaHCO3、NaCl中一种或几种,取10.6g样品,加入足量的稀盐酸产生气体4.8g,下列分析正确的是 ( )
A.一定含有NaHCO3 B.一定含有K2CO3
C.一定不含NaCl D.可能含有NaCl
|
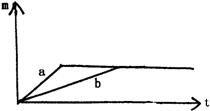
A.曲线a为钠,曲线b为钾
B.投入的Na的质量小于K的质量
C.投入的Na、K的质量一定相等
D.两个反应的盐酸中HCl必须足量
|
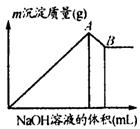
A.A点的沉淀是Mg (OH)2、Al (OH)3
B.B点的沉淀是Mg (OH)2、Al (OH)3
C.A点的沉淀是Al (OH)3
D.B点的沉淀是Mg (OH)2
19.将适量铁粉投入三氯化铁溶液中,完全反应后,溶液中的Fe2+和Fe3+浓度相等,则已反应的Fe3+和未反应的Fe3+的物质的量之比是 ( )
A.2 :3 B.3 :2 C.1 :2 D.1 :1
20.钠在空气中发生变化的过程是 ( )
A.Na→Na2O2→NaOH→Na2CO3·10H2O→Na2CO3
B.Na→Na2O2→NaOH→Na2CO3→NaHCO3
C.Na→Na2O→NaOH→Na2CO3·10H2O→Na2CO3
D.Na→Na2O→NaOH→Na2CO3→Na2HCO3
第Ⅱ卷(非选择题,共45分)
三、实验题(本题包括2小题,共20分)
|
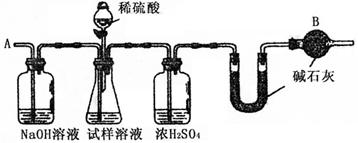
主要实验步骤如下:
①按图组装仪器,并检查装置的气密性
②将a g试样放入锥形瓶中,加适量蒸馏水溶解,得到试样溶液
③称量盛有碱石灰的U型管的质量,得到b g
④从分液漏斗滴入6 mol·L-1的硫酸,直到不再产生气体时为止
⑤从导管A处缓缓鼓入一定量的空气
⑥再次称量盛有碱石灰的U型管的质量,得到c g
⑦重复步骤⑤和⑥的操作,直到U型管的质量基本不变,为d g
请填空和回答问题:
(1)在用托盘天平称量样品中,如果天平的指针向左偏转,说明
(2)装置中干燥管B的作用是
(3)如果将分液漏斗中的硫酸换成浓度相同的盐酸,测试的结果 (填偏高、偏低或不变)
(4)步骤⑤的目的是
(5)步骤⑦的目的是
(6)该试样中纯碱的质量分数的计算式为
22.(8分)实验室配制0.5 mol·L-1的NaOH溶液500mL,有以下仪器:
①烧杯 ②胶头滴管 ③1000mL容量瓶 ④500mL容量瓶 ⑤玻璃棒
⑥托盘天平(带砝码) ⑦洒精灯
(1)配制时,必须使用的仪器有 (填代号)
(2)该实验两次用到玻璃棒,其作用分别是 、
(3)配制时一般可分为以下几个步骤:①称量 ②计算 ③溶解 ④转移 ⑤洗涤 ⑥定容 ⑦摇匀(两次分别排序) ⑧冷却
其正确的操作顺序为②①③
四、填空题(本题共2小题,共13分)
23.(6分)在Fe、Fe3+、Fe3+、S2-、SO2、Cu、H+、S等物质或粒子中:
(1)只能被氧化,不能被还原的是 ;
(2)只能被还原,不能被氧化的是 ;
(3)既能被氧化,又能被还原的是 ;
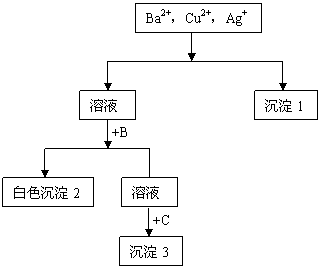 24.(7分)某溶液中含有Ba2+,Cu2+,Ag+,现用NaOH溶液、盐酸和Na2SO4溶液将这三种离子逐一沉淀分离。其流程图如下(写出最佳答案)
24.(7分)某溶液中含有Ba2+,Cu2+,Ag+,现用NaOH溶液、盐酸和Na2SO4溶液将这三种离子逐一沉淀分离。其流程图如下(写出最佳答案)
(1)沉淀的化学式:
沉淀1 ,
白色沉淀2 ,
沉淀3 ;
(2)写出混合液+A的离子方程式
溶液 + B的离子方程式
五、计算题(本题包括2小题,共12分)
25.(4分)将Na2CO3、10H2O和NaHCO3的混合物4.54g溶于水,得100mL溶液,其中Na+的物质的量为0.04mol。如将等质量的原混合物充分加热,至质量不再改变时,所得固体的质量是 克。
26.(8分)已知铜单质与稀硝酸会发生反应,化学方程式如下:
3Cu+8HNO3 = 3Cu(NO3)2 + 2NO↑+ 4H2O
现把3.2克铜单质加入到过量的8.4%的硝酸溶液中,充分反应后,问:
(1)有多少克HNO3被还原?
(2)生成多少克NO?
(3)这些铜单质能与多少克上述硝酸溶液恰好完全反应?
参考答案
一、单项选择题(每小题只有一个答案,每题2分,共10分)
| 题号 | 1 | 2 | 3 | 4 | 5 |
| 选项 | A | C | C | C | A |
二、选择题(每小题1—2答案,每题3分,共45分)
| 题号 | 6 | 7 | 8 | 9 | 10 | 11 | 12 | 13 | 14 | 15 | 16 | 17 | 18 | 19 | 20 |
| 选项 | C | BD | D | B | C | B | A | BC | C | C | AD | B | AD | A | C |
三、实验题(2小题,共20分)
21.(共12分,每空2分)
(1)样品重,砝码轻,或其它合理答案
(2)防止空气中CO2和水蒸气进入U型管
(3)偏高
(4)把反应产生的CO2全部导入U型管中
(5)判断反应产生的CO2是否全部排出并被U型管内碱石灰吸收
(6)![]()
22.(共8分,每空2分)
(1)①②④⑤⑥ (2)搅拌;引流 (3)⑧④⑤⑦⑥⑦
四、填空题(共13分)
23.(共6分,每空2分)
(1)Fe、S2、Cu (2)Fe3+、H+ (3)Fe2+、SO2、S
24.(共7分)
(1)(每空1分)沉淀1:AgCl 沉淀2:BaSO4 沉淀3:Cu(OH)2
(2)(每空2分)Ag+ + Cl = AgCl↓ SO42- + Ba2+ = BaSO4↓
五、计算题(共12分)
25.(4分)2.12g
26.(8分)(1)2.1g(3分) (2)1.0g(2分) (3)100g(3分)