高一化学第二学期第二次阶段性测试
本试卷分第Ⅰ卷(选择题)和第Ⅱ卷(非选择题)两部分,第Ⅰ卷1至4页,第Ⅱ卷5至8页,共120分,考试用时100分钟。
考生注意:
1.答题前,考生务必在答题卡上用钢笔或圆珠笔清楚填写姓名、班级,并用铅笔正确涂写考试号。
2.第Ⅰ卷(1~18题),由机器阅卷,答案必须全部涂写在答题卡上。考生应将代表正确答案的小方格用铅笔涂黑。注意试题题号和答题纸编号一一对应,不能错位。答案需要更改时,必须将原选项用橡皮擦去,重新选择。答案不能写在试卷上,写在试卷上一律不给分。
3.第Ⅱ卷(19~24题),该部分答案一律用钢笔或圆珠笔填写在答题纸上,写在试卷上一律不给分。
可能用到的相对原子质量:H—1, C—12, N—14,O—16,Al—27, S—32,Cl-35.5,
Ca-40,Fe—56,Cu-64,Zn—65
第Ⅰ卷(选择题,共60分)
一、选择题(本题包括10小题,每小题3分,共30分。每小题只有一个选项符合题意。)
1.下列表述正确的是
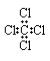 A.金刚石与12C互为同位素
B.NH3是由非极性键构成的
A.金刚石与12C互为同位素
B.NH3是由非极性键构成的
![]()
C.Na+的结构示意图: D.CCl4的电子式为
2.一定条件下,在一恒容密闭容器中,能表示反应 X(g) + 2Y(g) ![]() 2Z(g) 一定达到化学平衡状态的是
2Z(g) 一定达到化学平衡状态的是
① 容器中气体的密度不再发生变化 ② X、Y、Z的浓度不再发生变化
③ 容器中的压强不再发生变化 ④ 单位时间内生成n mol Z,同时生成2n mol Y
A.①② B.②③ C.③④ D.①④
3.在25℃、101 kPa下,1 g甲醇(CH3OH)燃烧生成CO2和液态水时放热22.68 kJ,下列
热化学方程式正确的是
A.2CH3OH(l)+3O2(g) 2CO2(g)+4H2O(l) △H=-1452 kJ/mol
B.2CH3OH(l)+3O2(g) 2CO2(g)+4H2O(l) △H=+725.8 kJ/mol
C.2CH3OH(l)+3O2(g) 2CO2(g)+4H2O(l) △H=+1452 kJ/mol
D.CH3OH(l)+3/2O2(g) CO2(g)+2H2O(l) △H=-22.68 kJ/mol
4.实验室用4mol SO2与2mol O2进行下列反应:
2SO2(g)+O2(g)
![]() 2SO3(g);△H=-196.6 kJ/mol
2SO3(g);△H=-196.6 kJ/mol
当放出314.56KJ热量时,SO2的转化率为
A.40% B.50% C.80% D.90%
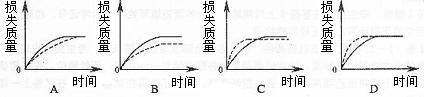
5.将A g块状碳酸钙跟足量盐酸反应,反应物损失的质量随时间的变化曲线如下图的实线所示,在相同的条件下,将B g (A>B)粉末状碳酸钙与同浓度足量盐酸反应,则相应的曲线(图中虚线所示)正确的是
6.A、B、C为三种短周期元素,A、B在同一周期,A、C的最低价离子为A2-和C-,B2+和C-具有相同的电子层结构。下列说法正确的是
A.原子序数:A>B>C B.原子半径:A>B>C
C.离子半径:A2->B2+>C- D.原子核外最外层电子数A>C>B
7.下列物质性质递变正确的是
A.HBr、HCl、HF熔沸点由高到低
B.H2O、H2S、HCl热稳定性逐渐增大
C.KOH、NaOH、Al(OH)3碱性逐渐减弱
D.Si、Cl、P元素单质的氧化性逐渐增强
8.向0.1mol·L-1CH3COOH溶液中加入少量CH3COONa晶体时,会引起
A.促进CH3COOH的电离 B.溶液的c(H+)减少
C.溶液的导电能力减弱 D.往溶液中加入锌粒不产生气体
9.下列事实可证明氨水是弱碱的是
A.铵盐受热易分解
B.0.1mol/L氨水可以使酚酞试液变红
C.氨水能跟氯化铁溶液反应生成氢氧化铁沉淀
D.0.1mol/L氨水溶液中c(OH-)= 0.001mol/L
10.某反应:A ![]() B + C 在室温下不能自发进行,在高温下能自发进行,对该反应过程
B + C 在室温下不能自发进行,在高温下能自发进行,对该反应过程
△H、△S的判断正确的是
A.△H<0、△S<0 B.△H>0、△S<0
C.△H<0、△S>0 D.△H>0、△S>0
二、选择题(本题包括10小题,每小题3分,共30分。每小题有一个或两个选项符合题意。若正确答案只包括一个选项,多选时,该题为0分;若正确答案包括两个选项,只选一个且正确的得1分,选两个且都正确的得满分,但只要选错一个该小题就为0分。)
11.下列说法正确的是
A.活化分子之间的碰撞一定是有效碰撞
B.能够发生化学反应的碰撞是有效碰撞
C.反应物分子的每次碰撞都能发生化学反应
D.增大反应物浓度时,单位体积内活化分子百分数增大
12.已知25℃、10lkPa条件下:
![]()
由此得出的正确结论是
A.由O3变O2为放热反应
B.由O3变O2为吸热反应
C.2mol O3的总能量小于3 mol O2的总能量
D.2mol O3的总能量大于3 mol O2的总能量
13.取c(H+)均为0.1mol/L的盐酸和醋酸各100ml分别,加入0.03g锌粉,在相同条件下充分反应,有关叙述正确的是
A.醋酸与锌反应放出氢气多
B.盐酸和醋酸分别与锌反应放出的氢气一样多
C.一开始时醋酸与锌反应速率快
D.一开始时盐酸和醋酸分别与锌反应的速率一样快
14.1840年,俄国化学家盖斯(G·H·Hess)从大量的实验事实中总结出了一条规律,即盖斯定律。盖斯定律在生产和科学研究中有很重要的意义,有些反应的反应热虽然无法直接测得,但可以利用盖斯定律间接计算求得。已知3.6 g碳在6.4 g的氧气中燃烧,至反应物耗尽,并放出X kJ热量。已知单质碳的燃烧热ΔH = -Y kJ/mol,则1mol C与O2反应生成CO的反应热△H为
A.-Y kJ/mol B.-(10X-Y) kJ/mol
C.-(5X-0.5Y) kJ/mol D.+(10X-Y) kJ/mol
15.在一密闭容器中,反应m A(g)+n B(g) ![]() 3 C(g)达到平衡时,测得c(A)=0.5 mol/L。在温度不变的情况下,将容积增大一倍,当达到新的平衡时,测得c(A)=0.25 mol/L。下列判断中正确的是
3 C(g)达到平衡时,测得c(A)=0.5 mol/L。在温度不变的情况下,将容积增大一倍,当达到新的平衡时,测得c(A)=0.25 mol/L。下列判断中正确的是
A.A的质量分数增加 B.平衡不移动
C.化学计量数:m+n=3 D.物质C的体积分数减小
16.一定条件下的密闭容器中,进行如下反应:
NO(g)+CO(g) ![]()
![]() N2(g)+CO2(g);ΔH=-373.2 kJ/mol
N2(g)+CO2(g);ΔH=-373.2 kJ/mol
为提高该反应的反应速率,缩短达到平衡的时间,下列措施不可取的是
A.加(正)催化剂 B.增大压强(体积减小)
C.给体系加热 D.从体系中不断移去部分CO2
17.对可逆反应4NH3(g)+5O2(g) ![]() 4NO(g)+6H2O(g),下列叙述正确的是
4NO(g)+6H2O(g),下列叙述正确的是
A.平衡时,v正(O2)=v逆(O2)必成立
B.关系式5v正(O2)=4v正(NO)总成立
C.用上述四种物质NH3、O2、NO、H2O表示的正反应速率的数值中,v正(H2O)最小
D.若投入4 mol NH3和5 mol O2,通过控制外界条件,必能生成4 mol NO
18.在4L密闭容器中充入6mol A气体和5mol B气体,在一定条件下发生反应:
![]() 3 A(g) + B(g) 2 C(g) + x D(g),达到平衡时生成2mol C,经测定c (D)=0.5mol·L-1
3 A(g) + B(g) 2 C(g) + x D(g),达到平衡时生成2mol C,经测定c (D)=0.5mol·L-1
下列判断正确的是
A.x=1
B.B的转化率为20%
C.平衡时A的浓度为1.50 mol·L-1
D.达到平衡时,在相同温度下容器内混合气体的压强是反应前的85%
19.在一密闭容器中通入A、B两种气体,在一定条件下反应:
![]() 2A(g)+ B(g) 2C(g);△H<0
2A(g)+ B(g) 2C(g);△H<0
当达到平衡后,改变一个条件(x),下列量(y)一定符合图中曲线的是
![]() y
y
|
| y |
| A. 温度 | 混合气体的密度 |
| B. 再加入B | A的物质的量 |
| C. 再加入A | B的转化率 |
| D. 压强 | C的百分含量 |
20.在一密闭容器中有如下反应:a X(g)+b Y(g)![]() n W(g);ΔH ,某化学兴趣
n W(g);ΔH ,某化学兴趣
小组的同学根据此反应在不同条件下的实验数据,作出了如下曲线图:
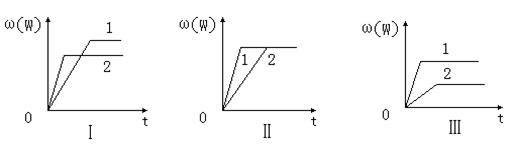
其中,ω(W)表示W在反应混合物中的体积分数,t表示反应时间。当其它条件不变时,下列分析正确的是
A.图Ⅰ可能是不同压强对反应的影响,且p2>p1,a+b<n
B.图Ⅱ可能是不同压强对反应的影响,且p1>p2,n<a+b
C.图Ⅱ可能是在同温同压下催化剂对反应的影响,且1使用的催化剂效果好
D.图Ⅲ可能是不同温度对反应的影响,且T1>T2,ΔH<0
高一化学第二学期第二次阶段性测试
第Ⅱ卷(非选择题,共60分)
三、(本题包括1小题,共12分)
21.(12分)为比较Fe3+和Cu2+对H2O2分解的催化效果甲乙两组同学分别设计了如图一、
图二所示的实验。
(1)写出H2O2在催化条件下分解的化学反应方程式: 。
(2)图一可通过观察 定性比较得出结论。有同学提出将CuSO4改为CuCl2更为合理,其理由是 ,你认为还可以作何改进? 。
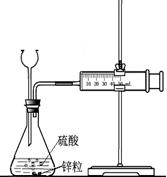
 |
图一 图二
(3)指出图二装置中一处明显的错误 。
图二所示实验中需测量的数据是 。
四、(本题包括3小题,共28分)
22.(10分)A、B、C、D、E都是元素周期表中前20号元素,原子序数依次增大,B、C、D同周期,A、D同主族,E和其它元素既不在同周期也不在同主族,D的最高价氧化物的水化物的酸性在同周期为最强,且B、C、D的最高价氧化物的水化物两两混合均能发生反应生成盐和水。F元素的一种同位素的中子数为0 。
根据以上信息,回答下列问题:
(1)A和D气态氢化物中,稳定性高的是 (选填“A”或“D”);A和B的离子中,半径较小的是 (填离子符号)。
(2)E元素的名称为 ,元素C在元素周期表中的位置是 。
(3)写出C的最高价氧化物的水化物分别与B、D的最高价氧化物的水化物反应的离子方程式 、 。
(4)写出2mol F元素的单质燃烧生成稳定化合物的热化学方程式 。
(已知:F元素的单质的燃烧热为ΔH = -285.8 kJ/mol)
23.(8分)在一定条件下,可逆反应:m A+n B ![]() p C达到平衡,若:
p C达到平衡,若:
(1)A、B、C都是气体,减少压强,平衡向正反应方向移动,则m+n和p的关系是 。
(2)A、C是气体,增加B的量,平衡不移动,则B为 态。
(3)A、C是气体,而且m+n=p,增大压强可使平衡发生移动,则平衡移动的方向是 。
(4)加热后,可使C的质量增加,则正反应是 反应(填“放热”或“吸热”)。
24.(10分)t℃时,将3molA和2molB气体通入体积为2L的密闭容器中(容积不变),发生如下反应:3A (g)+B (g) ![]() x
C(g),2min时反应达到平衡状态(温度不变),剩余1.8molB,并测得C的浓度为0.4mol/L,请填写下列空白:
x
C(g),2min时反应达到平衡状态(温度不变),剩余1.8molB,并测得C的浓度为0.4mol/L,请填写下列空白:
(1)v(B) = ,v(C) = ,x= 。
(2)比较达到平衡时,A、B两反应物的转化率之比为α(A):α(B)= ;
(3)若继续向原平衡混合物的容器中通入少量氦气(氦气和A、B、C都不反应)后,下列说法中正确的是____________(填写字母序号)
A.化学平衡向正反应方向移动 B.化学平衡向逆反应方向移动
C.化学平衡不会发生移动 D.正、逆反应的化学反应速率保持不变
五、(本题包括2小题,共20分)
25.(8分)某温度下,在一固定容积的密闭容器中投入一定物质的量的N2与H2进行可逆反应:
N2 (g)+3H2 (g) ![]() 2NH3 (g)
2NH3 (g)
在2 min时达到平衡状态,此时c(N2)=5.00 mol/L,c(H2)=10.00mol/L,c(NH3)=5.00 mol/L。
试求:
(1)该温度下,反应的平衡常数是多少?
(2)H2的起始浓度是多少?
(3)用N2表示该反应的反应速率是多少?
(4)N2的转化率(保留三位有效数字);
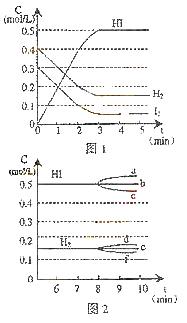 26.(12分)在某一容积为2 L的密闭容器内,加入0.8 mol的
26.(12分)在某一容积为2 L的密闭容器内,加入0.8 mol的
H2 和0.6 mol的I2,在一定的条件下发生如下反应:
H2 (g) + I2 (g
) ![]() 2HI (g) ΔH(ΔH<0)
2HI (g) ΔH(ΔH<0)
反应中各物质的浓度随时间变化情况如图1:
⑴ 该反应的化学平衡常数表达式为______________。
⑵ 根据图1数据,反应开始至达到平衡时,平均速率
v(HI)为__________________。(保留三位有效数字)
⑶ 反应达到平衡后,第8分钟时:
① 若升高温度,化学平衡常数K_______________
(填写增大、减小或不变)
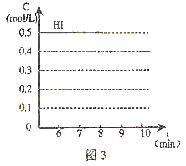 HI浓度的变化正确的是_________。
HI浓度的变化正确的是_________。
(用图2中的a—c的编号回答)
② 若加入I2,H2浓度的变化正确的是_______。
(用图2中的d—f的编号回答)
⑷ 反应达到平衡后,第8分钟时,若把容器的体积
扩大一倍,请在图3中画出8分钟后HI浓度的
变化情况。
试卷到此结束,做完后请认真检查。
高一化学第二学期第二次阶段性测试
参考答案
一、二选择题:
| 题号 | 1 | 2 | 3 | 4 | 5 | 6 | 7 | 8 | 9 | 10 |
| 答案 | C | B | A | C | C | A | C | B | D | D |
| 题号 | 11 | 12 | 13 | 14 | 15 | 16 | 17 | 18 | 19 | 20 |
| 答案 | B | AD | BD | C | BC | D | A | B | CD | AC |
![]() 三、(本题包括1小题,共12分)
三、(本题包括1小题,共12分)
21.(1)2H2O2 2H2O + O2↑
(2)反应产生气泡快慢或反应完成的先后或试管壁的冷热程度;
控制阴离子相同,排除阴离子的干扰;
将FeCl3改为Fe2(SO4)3 。
(3)长颈漏斗应换为分液漏斗;
一定时间内收集到的气体体积或收集一定体积的气体所需要的时间(每空2分共12分)
四、(本题包括3小题,共28分)
22. (1) A Na+ (每空1分 ) (2) 钙 第三周期、ⅢA族 (每空1分 )
(3)Al(OH)3+3H+=Al3++3H2O Al(OH)3+OH-=AlO2 -+2H2O (每空2分)
(4)2H2(g)+O2(g) ====2H2O (l);△H=-571.6 kJ/mol (2分)
23.(1)m+n < p(2)固或液(3)逆反应方向(或向左移动)(4)吸热 (每空2分共8分)
24.(1)0.05 mol/(L·min) 0.2 mol/(L·min) x=4
(2) 2:1 (3)C、D (速率不带单位不给分。每空2分,共10分)
五、(本题包括2小题,共20分)
25.(1)K=5.00×10-3 (2分) (2)c (H2)始=17.50 mol/L (2分)
(3)v(N2)=1.25 mol/(L·min) (2分) (4)α(N2)=33.3% (2分)
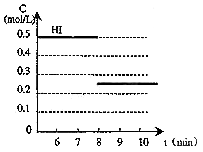
![]()
26.
⑴
⑵
0.167mol/(L·min)
⑶ ① 减小 c
② f
⑷ 见右图 (每空2分,共12分)
 x
x