高一化学秋季实验班期中考试试题
化 学
(考试时间:90分钟。分值:110分。命题人:夏国新)
本卷可能用到的相对原子质量:H:1 C:12 N:14 O:16 Na:23 Mg:24
Al:27 K:39 Fe:56 Cu:64 Zn:65
第Ⅰ卷(选择题 共54分)
一.选择题(本题共有6个小题,每小题2分,共12分.每小题只有一个正确答案。)
1.研究物质性质的基本程序是:a.预测其性质;b.解释及结论;c.观察其外貌;d实验和观察
A. dbca B.cbda C. cadb D.acdb
2.下列说法中正确的是
A.摩尔既是物质的数量单位又是物质的质量单位 B.物质的量是国际单位制中七个基本单位之一
C.阿伏加德罗常数是12 g 12C中含有的碳原子数目 D.标准状况下,1 mol H2O所占的体积为22.4L
3.某化合物易溶于水,但其水溶液不导电,则该物质是
A.强电解质 B.弱电解质 C.非电解质 D.不能确定其类型
4.下列两种气体的分子数一定相等的是
A.等温等体积的O2 和N2 B. 等压等体积的N2 和CO2
C.质量相等、密度不等的N2 和C2H4 D. 体积相等、密度相等的CO 和H2
5.煤不完全燃烧造成的后果是
①产热少,浪费资源 ②增加CO2的排放量
③产生CO和烟尘污染环境 ④燃烧产生大量的SO2会导致酸雨
A.①③ B.①④ C.②③ D.③④
6.人体血红蛋白中含有Fe2+,若误食亚硝酸盐,会导致Fe2+转化Fe3+而中毒,服用维生素C可以解毒。对上述现象的分析正确的是
A.亚硝酸盐是还原剂 B.维生素C是氧化剂
C.亚硝酸盐被氧化 D.维生素C将Fe3+还原成Fe2+
二.选择题(本题包括14小题,每小题3分,共42分。每小题有一个或两个选项符合题意。)
7.用NA表示阿伏加德罗常数的值,下列说法中不正确的是
A.磷酸的摩尔质量(以g/mol为单位)与NA 个磷酸分子的质量(以g为单位)在数值上相等
B.NA个氮分子和NA个氢分子的质量比等于14∶1
C.1 mol CH3+(碳正离子)中含有电子数为10 NA
D.32g氧气所含的原子数目为2 NA
8.下列关于钠的叙述中正确的是:①钠与水反应时浮于水面且呈小球状游动 ②钠可以保存在四氯化碳中 ③钠元素在自然界中只能以化合态形式存在 ④钠可从硫酸铜溶液中置换出铜 ⑤金属钠只有还原性而没有氧化性
A.①②③ B.③④⑤ C.②③⑤ D.①③⑤
9.向盛有水的小烧杯中先滴入酚酞试液,然后加入过氧化钠,现象是
A.有气体产生,酚酞变红 B.有气体产生,酚酞先变红而后褪色
C.有气体产生,溶液变浑浊,酚酞变红 D.有气体产生,溶液变浑浊,酚酞不变色
10.在容积可变的密闭容器中,加入a L氙气和b L氟气(F2),在2635 K Pa和400℃下加热数小时后迅速冷却至室温,除剩余b/2 L氟气外,还得到一种无色晶体,则所得无色晶体中氙与氟的原子个数比为
A.2a︰b B.a︰b C.4a︰b D.a︰2b
11.某学生只有下列仪器和用品:烧杯、试管、量筒、铁架台(带铁夹)、酒精灯、集气瓶、玻璃片、水槽、导气管、橡皮塞、橡皮管、玻璃棒、药匙、火柴。从缺少仪器和用品的角度看,该学生不能进行的实验操作是
A.用Zn 粒制取H2 B.用CuSO4溶液制取CuO固体
C.用 CO 还原 FeO D.用NaCl晶体配制20%的NaCl溶液
12. 钾和氧组成的某种离子晶体含钾的质量分数是78/126,其阴离子只有过氧离子(O22-)和超氧离子( O2-)两种。在此晶体中,过氧离子和超氧离子的物质的量之比为
A 2:1 B 1:1 C 1:2 D 1:3
13.a L CO和O2的混和气体,点燃后完全反应,剩余bL气体(反应前后气体测定条件相同),则原混和气体中CO的体积可能为:①b;②2a/3;③a-b;④a+b;⑤2(a-b)
A.①②③ B.②④⑤ C.①②④ D.①②⑤
14.已知PbSO4难溶于水,也难溶于硝酸,却可溶于醋酸铵溶液中形成无色溶液,其化学方程式为:PbSO4+2CH3COONH4=(CH3COO)2Pb+(NH4)2SO4。(CH3COO)2Pb溶液难导电,当向溶液中通入H2S气体时,有PbS黑色沉淀生成,下列表示这个化学反应的反应式中正确的是
A.(CH3COO)2Pb+H2S==PbS↓+2CH3COOH
B.Pb2++H2S===PbS↓+2H+
C.Pb2++2CH3COO-+H2S==PbS↓+2CH3COOH
D.Pb2++2CH3COO-+2H++S2-===PbS↓+2CH3COOH
15.已知: (1)H2S+I2=2H++2I-+S¯; (2)H2SO3+2H2S=3S¯+3H2O; (3)2I-+Br2=2Br-+I2;
(4)H2SO3+I2+H2O=H2SO4+2HI 。则Br-、I-、H2S和H2SO3还原性由强到弱的顺序是
A.H2S>H2SO3>I->Br- B.Br->I->H2SO3>H2S C.H2SO3>H2S>Br->I- D.I->Br->H2S>H2SO3
16. 在强酸性的无色溶液中,下列离子能大量共存的是
A、NH4+、Ba2+、NO3-、CO32-![]() B、Fe2+、 SO42-、MnO4-、OH-
B、Fe2+、 SO42-、MnO4-、OH-![]()
C、K+、Mg2+、NO3-、SO42-![]() D、Al3+、Na+、Cl-、NO3-
D、Al3+、Na+、Cl-、NO3-![]()
17.下列有关气体体积的叙述中,正确的是
A.一定的温度、压强下,各种气体的体积大小,由构成气体的粒子自身的体积大小决定。
B.一定的温度、压强下,各种气体的体积大小由构成气体的粒子的数目多少决定。
C.不同的气体,若体积不同,则它们所含有的粒子数目也一定不相同。
D.一定的温度、压强下,各种气体的物质的量决定了它们所占体积的大小。
18.在酸性溶液中(加热并有Ag+催化)可发生反应:2Mn2++5R2O8x-+8H2O=16H++10RO42-+2MnO4-,根据上述反应,则R2O8x-中x的值是:
A.4 B.3 C.2 D.1
19.最近德国科学家实现了铷原子气体超流体态与绝缘态的可逆转换,该成果将在量子计算机研究方面带来重大突破。已知铷是37号元素,下列关于铷的结构和性质的判断正确的是:①与水反应比钠剧烈 ②它的原子半径比钠小 ③它的氧化物暴露在空气中易吸收二氧化碳 ④它的阳离子最外层电子数和镁原子相同 ⑤它是还原剂
A.①③④ B.②③⑤ C.②④ D.①③⑤
20.若以![]() 表示CO2的摩尔质量,v表示在标况下CO2的摩尔体积,ρ为在标况下CO2的密度,NA为阿伏加德罗常数,m、△分别表示每个二氧化碳分子的质量和体积,下面是四个关系式:
表示CO2的摩尔质量,v表示在标况下CO2的摩尔体积,ρ为在标况下CO2的密度,NA为阿伏加德罗常数,m、△分别表示每个二氧化碳分子的质量和体积,下面是四个关系式:
①![]() ②
②![]() ③
③![]() ④
④![]() 其中正确的是
其中正确的是
A.①和② B.①和③ C.②和④ D.①和④
第Ⅱ卷(非选择题 共56分)
三.填空题(本题包括3小题,计22分)
21.(6分)通常用NaHCO3悬浮液除去混在CO2气体中的少量HCl气体,其离子方程式为______________________,而不用NaOH溶液的原因(用离子方程式表示)为________________________________,也不用饱和Na2CO3溶液的原因(用离子方程式表示)为_______________________________。
22.(8分)“绿色试剂”双氧水可作为矿业废液消毒剂,如可用来消除采矿业废液中的氰化物(如KCN),化学方程式为:KCN+H2O2+H2O===A+NH3↑
(1)生成物A的化学式为 。
(2)在标准状况下有0.448L氨气生成,则转移电子物质的量为 。
(3)反应中被氧化的元素为 。
(4)H2O2被称为绿色氧化剂的理由是
。
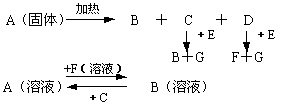 23.(8分)下图中A至F是化合物,G是单质。
23.(8分)下图中A至F是化合物,G是单质。
(1) 写出A、D、E、G的化学式:
A ;D ;
E ; G 。
(2) 完成下列反应式:
①写出溶液B转化为溶液A的离子方程式:
②E与SO2反应的化学方程式: 。
四.实验题(本题有2小题,计21分)
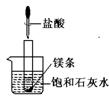 24.
(8分)如图所示,把试管放入盛有25℃的饱和澄清石灰水中,试管中先放入几小块镁片,再用滴管滴入5 mL盐酸于试管中。试回答下列问题:
24.
(8分)如图所示,把试管放入盛有25℃的饱和澄清石灰水中,试管中先放入几小块镁片,再用滴管滴入5 mL盐酸于试管中。试回答下列问题:
(1) 实验中观察到的现象是: ① ;
② 。
(2)产生上述现象的原因是
。
(3)写出有关反应的离子方程式: 。
(4)由实验推知,MgCl2溶液和H2的总能量 (填“大于”或“小于”或“等于”)镁片和盐酸的总能量。
25.(13分)为证明有关物质的性质,某学生设计了如下图所示的装置:
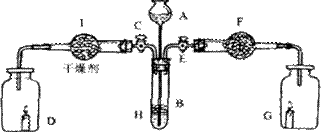
当关闭E打开活塞C,使液体A与搁板H上的固体B相遇时,即有气体产生,并发现D中蜡烛慢慢熄灭;关闭C打开E时,则看到G中蜡烛燃得更亮。请回答:
(1)该装置中有关仪器内盛放的物质(填名称):A ,B ,F 。
(2)I中干燥剂可选择(填代码): ;
A、浓硫酸 B、碱石灰 C、无水氯化钙
(3)B与A中液体反应的离子方程式为 。
(4)打开E时,干燥管F中发生反应的有 个,其中主要反应的化学方程式为: 。
四.计算题(本题有2小题,计13分)
26.(5分)200℃时,11.6 g CO2和水蒸气的混合气体与足量的Na2O2充分反应后固体质量增加了3.6 g,求原混合物中CO2和H2O的物质的量之比为 。
27.(8分)(1)在标况下,用4.2gNaHCO3和200mL 含0.5mo HCl的盐酸反应制CO2,理论上可制备
CO2 L。
(2)实际上由于一部分CO2溶解在反应后的混和溶液中,收集的CO2气体减少,已知每升溶液溶解CO2 1.2L,则实际收集CO2 升(假设溶液体积变化忽略不计)。
(3)如果某学生将实际质量为13.2g的NaHCO3错误地放在托盘天平的右盘上进行称量(5克以下用游码),根据他的称量结果进行计算,这些NaHCO3加热分解放出CO2的物质的量为 。
答题卷
| 题号 | 1 | 2 | 3 | 4 | 5 | 6 | 7 | 8 | 9 | 10 |
| 答案 | ||||||||||
| 题号 | 11 | 12 | 13 | 14 | 15 | 16 | 17 | 18 | 19 | 20 |
| 答案 |
21.(6分) ; ;
22.(8分)(1) (2) (3)
(4) 。
23.(8分)(1) A: ;D: ;E: ;G:
(2)①
②
24.(8分)(1)① ;② 。
(2) 。
(3)
(4) 。
25.(13分)(1) ; ;
(2)
(3)
(4) ;
26.(5分) 。
27.(8分)(1)(3分)
(2)(2分)
(3)(3分)
答题卷
一、选择题
| 题号 | 1 | 2 | 3 | 4 | 5 | 6 | 7 | 8 | 9 | 10 |
| 答案 | C | C | C | C | A | D | C | D | B | B |
| 题号 | 11 | 12 | 13 | 14 | 15 | 16 | 17 | 18 | 19 | 20 |
| 答案 | BD | C | D | A | A | CD | BD | C | D | B |
21.(6分) HCO3一+H+==H2O+CO2↑; CO2+2OH-== CO32- +H2O; CO32-+CO2+ H2O ==2 HCO-3
22.(8分)(1)KHCO3 (2)0.04mol (3)碳(或C)
(4)H2O2作氧化剂,其还原产物是H2O;H2O没有毒性及污染性。
23.(8分)(1) A:NaHCO3;D:H2O;E:Na2O2;G:O2 (各1分)
(2)①CO32-+H+=HCO3-(或CO32-+CO2+H2O=2HCO3-) (2分)
② Na2O2+SO2=Na2SO4 (2分)
24.(8分)(1)①小试管中镁条溶解,产生无色气体;②烧杯中出现浑浊现象。
(2)镁与盐酸反应析出氢气,并放出大量热,降低了氢氧化钙的溶解度。
(3)Mg+2H+=Mg2++H2↑
(4)小于
25.(13分)(1) 稀盐酸 ; 大理石(或碳酸钙) ; 过氧化钠
(2) C
(3)CaCO3+2H+=Ca2++CO2↑+ H2O
(4) 3 ; 2Na2O2+2H2O=4NaOH+O2↑
26.(5分) 1:4 。
27.(8分)(1)(3分)1.12升
(2)(2分) 0.88 升
(3)(3分)0.1mol