高一化学秋学期期中考试试题
考试时间:100分钟 分值:100分
可能用到的相对原子质量:H 1 O 16 Mg 24 Al 27 S 32
第Ⅰ卷(选择题 共66分)
一、选择题(本大题包括22小题,每小题只有一个选项符合题意,每题3分,共66分)
1.化学药品包装瓶上常有一些警示标志,如剧毒品、氧化剂、自燃、及腐蚀品等。其中属于腐蚀品标志的是: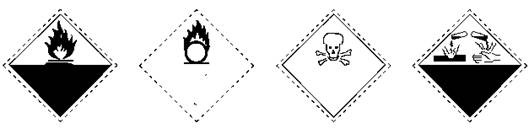
A B C D
2.下列说法正确的是
A.蔗糖属于电解质 B.豆浆属于胶体
C.氯气属于非电解质 D.纯碱属于碱
3.既属于钠盐又属于硫酸盐的是
A.Na2SO3 B.Na2SO4 C.Na2S D.NaOH
4.下列物质中,不属于电解质的是
A.NaOH B.H2SO4 C.蔗糖 D.NaCl
5.纳米科技是人类认识和改造世界能力的重大突破,将引发下一场新的技术革命和产业革命,现已成为21世纪科学技术发展的前沿。下列分散系中的分散质直径与纳米粒子直径大致相当的是
A.溶液 B.乳浊液 C.悬浊液 D.胶体
6.符合H+ +OH-=H2O这一离子方程式的是
A.氢氧化钡和硫酸 B.氢氧化钡和盐酸
C.氢氧化铜与盐酸 D.氢氧化铁胶体与盐酸
7.2005年6月5日世界环境日,我国确定的主题是:“人人参与,创建绿色家园!”下列行为不符合这一主题的是
A.将废电池集中回收处理,防止污染水源和土壤污染
B.加强新能源研究,使用压缩天然气、氢气作汽车燃料
C.射阳加大县城环境整治,建大型污水处理场
 D.提倡使用一次性筷子和纸质贺卡
D.提倡使用一次性筷子和纸质贺卡
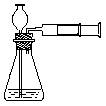
8.实验室实验时也可用推拉注射器活塞的方法检查右图中装置的气密性。当向外拉活塞时,如果装置气密性良好,可能观察到
A.长颈漏斗下端口产生气泡 B.瓶中液面明显上升
C.长颈漏斗内的液面上升 D.注射器内有液体
9.钠离子(Na+)的结构示意图为: 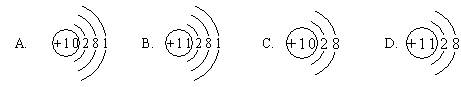
10.氧化还原反应的实质是
 A.原子重新组合 B.氧原子的得失
A.原子重新组合 B.氧原子的得失
C.电子的得失或共用电子对的偏移 D.化合价的改变
11.下组中,可用右图装置进行的分离实验是
A.将海水转化为淡水
B.碘的四氯化碳溶液与水溶液的分离
C.除去食盐中的不溶的泥沙
D.除去硝酸钾中少量的食盐
12.将标准状况下22.4L的氯化氢气体溶于水得2L溶液,其物质的量浓度为
A.11.2mol/L B.1mol/L C.0.5mol/L D.22.4mol/L
13. 下列各组离子在溶液中可以大量共存的是
A.Fe3+ Na+ OH- Cl- B.Ba2+ Cu2+ SO42- NO3 -
C.K+ Na+ CO32- OH- D.H+ NH4+ HCO3- OH-
14.下列物质所含粒子数最多的是
A.标准状况下22.4L水 B.64gSO2
C.54gAl D.标准状况下,67.2L氢气
15.在下列反应中,属于氧化还原反应的是
A.CaCO3 +2HCl= CaCl2 + CO2↑ +H2O
B.CaO + H2O = Ca(OH)2
C.2H2O2 ![]() 2H2O + O2↑
2H2O + O2↑
D.CaCO3 ![]() CaO + CO2↑
CaO + CO2↑
16.用下图装置测定水中氢、氧元素的质量比,其方法是分别测定通氢气前后玻璃管的质量差和U型管的质量差,实验测得m(H):m(O)>1:8。下列对导致这一结果的原因的分析中,一定错误的是
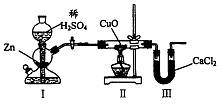 A.I、Ⅱ装置之间缺少干燥装置
A.I、Ⅱ装置之间缺少干燥装置
B.CuO没有全部被还原
C.Ⅱ装置中玻璃管内有水冷凝
D.Ⅲ装置后缺少干燥装置
17.只用一种试剂就能将BaCl2、NaCl、KOH三种无色溶液区别开,此试剂是
A.Na2CO3 B. 盐酸 C. 硫酸 D.Fe2(SO4)3溶液
18.今有FeCl3溶液、Fe(OH)3胶体以及氢氧化铁的浊液,下列说法正确的是
A.这三种分散系中,氢氧化铁浊液最稳定
B.将FeCl3溶液中加入足量的氢氧化钠溶液就可得到红褐色Fe(OH)3胶体
C.氢氧化铁胶体过滤时,滤纸上得到氢氧化铁,滤液中是纯水
D.Fe(OH)3胶体能发生丁达尔现象
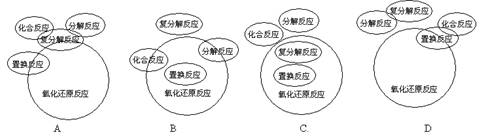
19.化合反应、分解反应、置换反应、复分解反应与氧化还原反应的交叉分类示意图正确的是
20.火星探测器发回的信息表明,火星上存在针铁矿[化学式:FeO(OH)]和黄钾铁矾,从而证明火星表面曾经存在过水。这一发现被美国《科学》杂专评为2004世界十大新闻之首。已知两种矿物中铁的价态相同,则黄钾铁矾{化学式记为:KFe3(SO4)2(OH)n}中n值为:
A.4 B.5 C.6 D.7
![]() 21.有关反应:2CuO + C 2Cu + CO2↑的说法不正确的是
21.有关反应:2CuO + C 2Cu + CO2↑的说法不正确的是
A.该反应属于置换反应 B.C→CO2属于氧化反应
C.CuO→ Cu属于还原反应 D.碳在反应中得到电子
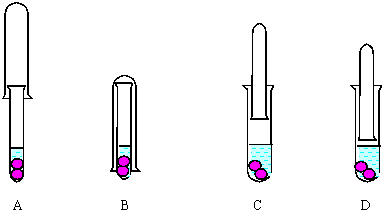
22.某学生打算用如图所示(一大一小)两支试管,用锌和稀硫酸反应来制取氢气,一支作反应器,一支收集.设计的装置及反应开始时两试管相对位置正确的是
 |
(请您将答案填在下页的答题卡上,这一张不上交!)
高一化学秋学期期中考试试题
高一化学试题答题卡
第Ⅰ卷答案
| 题号 | 1 | 2 | 3 | 4 | 5 | 6 | 7 | 8 | 9 | 10 | 11 |
| 答案 | |||||||||||
| 题号 | 12 | 13 | 14 | 15 | 16 | 17 | 18 | 19 | 20 | 21 | 22 |
| 答案 |
第Ⅱ卷(非选择题,共34分)
二、(本题包括23、24、25、26四小题,28分)
23.(10分)试回答下列中学化学实验室中常见仪器的有关问题:
(1)在仪器①分液漏斗、②试剂瓶、③集气瓶、④滴瓶、⑤滴定管、⑥容量瓶、⑦量筒、⑧托盘天平 中,标有“0”刻度的是(填序号,下同)__________________;
标有使用温度的仪器是_________________________。
(2)“磨砂”是增加玻璃仪器密封性的一种处理工艺。在仪器 ①试管、②分液漏斗、③细口试剂瓶、④广口试剂瓶、⑤集气瓶、⑥滴瓶、⑦酸式滴定管、⑧碱式滴定管 中,用到“磨砂”的有______________________________。
(3)在仪器①漏斗、②容量瓶、③蒸馏烧瓶、④分液漏斗、⑤烧杯、⑥蒸发皿 中,可用于粗盐提纯实验的有 ;可用于分离两种沸点接近且互不相溶的液态混合物实验的有 。
24.(8分)分别用一种试剂将下列物质中混入的少量杂质除去(括号内为混入的杂质)
| 物 质 | 需加入的试剂 | 有关离子方程式 | |
| 1 | HNO3(H2SO4) | ||
| 2 | NaCl(Na2CO3) | ||
25.(2分)萃取是一种常用的分离液-液混合物的方法,它是利用溶质在互不相溶的溶剂里溶解度的不同,用一种溶剂把溶质从它与另一溶剂所组成的溶液里提取出来的操作,下列是从碘水中萃取碘的操作,正确的顺序是: 。(填序号)
① 当液体分层后,将分液漏斗活塞打开,或使塞上的凹槽(或小孔)对准漏斗上的小与漏斗口颈上的小孔,再将分液漏斗下面的活塞打开,使下层液体慢慢流出。
② 用量筒量取10mL碘的饱和水溶液,倒入分液漏斗,然后再注入4mL四氯化碳,盖好玻璃塞。
③ 用右手压信分液漏斗口部,左手握住活塞部分,把分液漏斗倒转过来用力振荡。
④ 把分液漏斗放在铁架台的铁圈上,静置。
26.(8分)欲配制500mL2mol/L的MgSO4溶液。
(1)现在下列仪器:托盘天平、药匙、烧杯、量筒、玻璃棒,还缺少的玻璃仪器有 和 。
(2)需称取无水硫酸镁的质量为: g。
(3)配制时包含如下图所示的几个步骤,正确的操作顺序是: (填字母序号)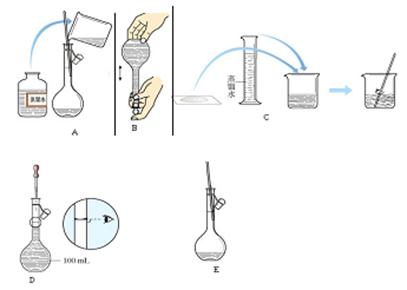
(4)若某同学用容量瓶配制溶液时,加水超过了刻度线,就倒出一些,又重新加水至刻度线,你认为这种方法对吗?这样做造成什么结果?说出你的见解!
。
三、计算
27.(6分)在标准状况下,将224L的HCl气体溶于635mL的水中(设水的密度为1.00g/cm3),求所得盐酸的质量分数。若取出这种盐酸(密度为1.19g/cm3)10.0mL稀释至1190mL,则稀释后盐酸的物质的量浓度为多少?
化学试卷参考答案
第Ⅰ卷答案
一、选择题,每题3分,共66分
| 题号 | 1 | 2 | 3 | 4 | 5 | 6 | 7 | 8 | 9 | 10 | 11 |
| 答案 | D | B | B | C | D | B | D | A | D | C | B |
| 题号 | 12 | 13 | 14 | 15 | 16 | 17 | 18 | 19 | 20 | 21 | 22 |
| 答案 | C | C | A | C | B | D | D | B | C | D | B |
二、填空题,每空2分,共28分
23.⑴⑤⑧ ; ⑤⑥⑦ ⑵ ②③④⑤⑥⑦; ⑶ ①⑤⑥ ; ④⑤
24.(1)硝酸钡溶液,Ba2+ +SO42- = BaSO4↓
(2)盐酸(或氯化钡溶液、氯化钙溶液)2H+ +CO32- = CO2↑ +H2O(Ba2+ +CO32- = BaCO3↓;Ca2+ +CO32- =CaCO3↓)
25. ②③④①
26.(1)500mL容量瓶,胶头滴管
(2)120g
(3)CEADB
(4)不正确;会造成偏低的误差
三、计算题(6分)
27. 36.5% 0.100mol/L