高一化学第一学期期中测试
试题卷
命题人:吴亨祥 校对人:陶秋娣
本试卷分为第I卷和第II卷两部分。满分100分,考试时间90分钟。将答案都做在答题卷上,做在试卷上的无效。
本卷可能所需的相对原子质量:Fe:56 ,Cu: 64 ,O:16 ,Na:23 ,C:12 ,H:1 ,S:32
第I卷
一、选择题(本题共25小题,每小题2分,共50分,只有一个正确选项)
1、氢元素与其他元素形成的二元化合物称为氢化物,下面关于氢化物的叙述正确的是:
A.一个D2O分子所含的中子数为10 B.NH3是一种弱电解质
C.HCl的水溶液没有氧化性 D.HI 能使淀粉变蓝色
2、用高能![]() 核轰击
核轰击![]() 核,发生核合成反应,得到新原子
核,发生核合成反应,得到新原子![]() ,该原子中中子数与核外电子数之差为:
,该原子中中子数与核外电子数之差为:
A.161 B.53 C.108 D.55
3、医学上常给病人口服Na126I溶液来诊断甲状腺疾病。这是由于合成甲状腺激素的重要原料是:
A.铁 B.钙 C.碘 D.钠
4、下列物质中属于弱电解质的是:
A.CO2 B.(NH4)2SO4 C.Cl2 D.CH3COOH
5、除去NaCl中含有的Ca2+、Mg2+、SO42-、HCO3-等离子,通常采用以下四种试剂:
① Na2CO3 ② BaCl2 ③ NaOH ④ HCl。加入试剂合理的操作顺序是:
A.①②③④ B.③①②④ C.③②①④ D. ④②①③
6、在无色溶液中,下列各组离子能够大量共存的是:
A.Cl -、Na+、NO3-、Ca2+ B.NH4+、OH-、Cl-、K+
C.K+、Ba2+、Cl-、SO42- D.H+、NH4+、HCO3-、Cl-
7、能正确表示下列化学反应的离子方程式的是:
A.氢氧化钡溶液与硫酸的反应 OH-+H+ = H2O
B.澄清的石灰水与稀盐酸反应 Ca(OH)2 + 2H+ = Ca2+ + 2H2O
C.铜片插入硝酸银溶液中 Cu + Ag+ = Cu2+ + Ag
D.碳酸钙溶于稀盐酸中 CaCO3+2H+=Ca2++H2O+CO2
8、下列变化需要加入还原剂才能实现的:
A.MnO4-![]() Mn2+ B.HCl
Mn2+ B.HCl![]() Cl2
Cl2
C.Fe![]() Fe3+ D.KCl
Fe3+ D.KCl![]() AgCl
AgCl
9、亚硝酸(HNO2)参加反应时,既可作氧化剂,也可作还原剂。当它作还原剂时,可能生成的产物是:D
A.NH3 B.N2 C.N2O3 D.HNO3
10、配制一定物质的量浓度的NaOH溶液时,造成所配溶液浓度偏高的原因是:
A.所用NaOH已吸潮 B.向容量瓶加水时液面低于刻度线即摇匀
C.有少量NaOH溶液残留在烧杯内 D.向容量瓶加水时眼睛一直仰视液面
11、根据我省中心气象台报道,近年每到春季,我省沿海一些城市多次出现大雾天气,致使高速公路关闭,航班停飞。雾属于下列分散系中的:
A.溶液 B.悬浊液 C.乳浊液 D.胶体
12、某非金属单质A和氧气发生化合反应生成B。B为气体,其体积是反应掉氧气体积的两倍(同温同压)。以下对B分子组成的推测一定正确的是:
A.有1个氧原子 C.有2个氧原子 C.有1个A原子 D.有2个A原子
13、下列物质的用途,不正确的是:
A.二氧化氯用于饮用水的消毒 B.溴化银用于人工降雨
C.钠和钾的合金用于快中子反应堆 D.氧化镁用于作耐高温材料
14、在2NaBr + Cl2 === 2NaCl + Br2 反应中,还原性最强的物质
A.NaCl B.Cl2 C.NaBr D.Br2
15、钾(K)与Na在性质上具有很大的相似性,但K比Na的活泼性强,下面是根据Na的性质对K的性质的预测,其中正确的是:
A.因为K的活泼性强,所以少量钾应该保存在煤油里
B.K在空气可以被空气中的氧气所氧化,且燃烧产物只有K2O
C.K 与水能够反应,但不如Na与水的反应剧烈,但产物都有氢气
D.K可以与硫酸铜溶液剧烈反应,置换出铜,并生成硫酸钾
16、下列关于碳酸钠和碳酸氢钠的比较中,正确的是:
A.相同温度下,在水中,碳酸氢钠的溶解度大于碳酸钠的溶解度
B.碳酸钠的热稳定性大于碳酸氢钠的热稳定性
C.相同质量的两种固体分别与100 mL 0.100 mol/mol盐酸反应,放出二氧化碳气体是碳酸氢钠多,但反应速率是碳酸钠的大
D.二者水溶液都显碱性,但物质的量浓度相同时,碳酸氢钠溶液的pH大于碳酸钠溶液的pH
17、下列叙述正确的是:
A.氯气的性质很活泼,它与氢气混合后立即发生爆炸
B.实验室制取氯气时,为了防止环境污染,多余的氯气可以用氢氧化钙溶液吸收
C.检验HCl气体中是否混有Cl2方法是将气体通入硝酸银溶液
D.除去Cl2气体中的HCl,可将气体通入饱和食盐水
18、在某化学反应中,若铜离子得到的电子数为2.408×1023 ,则可得到铜单质:
A.25.6 g B.32 g C.12.8 g D.38.4 g
19、已知M2O7x- + 3 S2- + 14 H+ = 2 M 3+ + 3S ↓ + 7H2O,则M2O7x-中的M的化合价为
A. +2 B.+3 C.+4 D. +6
 20、下列指定微粒的个数比为2∶1的是
20、下列指定微粒的个数比为2∶1的是
A.H2+ 离子中的电子和质子
B.![]() 原子中的中子和质子
原子中的中子和质子
C.C 原子中的最外层电子数与次外层电子数
D.NaHCO3晶体中的阳离子和阴离子
21、下列反应中,氧化剂与还原剂物质的量的关系为1:2的是:
A.O3+2KI+H2O=2KOH+I2+O2
B.2CH3COOH+Ca(ClO)2=2HClO+ (CH3COO)2 Ca
C.I2+2NaClO3=2NaIO3+Cl2↑
D.2HCl+Mg=MgCl2+H2↑
22、300 mL某浓度的NaOH溶液中含有60 g溶质。现欲配制1 mol·L-1NaOH溶液,应取原溶液与蒸馏水的体积比约为:
A.1∶5 B.1∶4 C.2∶1 D.2∶3
23、科学家已发现一种新型氢分子,其化学式为H3,等质量的H3和H2一定相同的是:
A.体积 B.分子数 C.原子数 D.物质的量
24、随着人们生活节奏的加快,方便的小包装食品已被广泛接受。为了延长食品的保质期,防止食品氧化变质,在包装袋中可以放入的化学物质能达到此效果的是:
A.无水硫酸铜 B.硫酸亚铁 C. 食盐 D. 生石灰
25、为了确定某物质是否变质,所选试剂(括号内物质)达不到实验要求的是:
A、K2SO3是否被氧化(BaCl2) B、新制氯水已经完全变质(品红试液)
C、KI是否被氧化(淀粉溶液) D、漂白粉是否变质(盐酸)
第II卷
二、填空题:(共2小题,8分)
26、KMnO4 与浓度为12.0 mol/L 的浓盐酸在常温下就可以反应,实验室有时就用这种方法制取少量氯气。反应方程式如下:
2 KMnO4 + 16 HCl = 2 KCl + 2 MnCl 2+ 5Cl 2↑ + 8 H2O
其中氧化剂是 ,氧化产物是 。在方程式上标明电子转移的方向和数目。
27、化工生产中常常用到“三酸两碱”,“三酸”指硝酸、硫酸和盐酸,“两碱”指烧碱和纯碱。
(1)从物质的分类角度看,不恰当的一种物质是___________ 。
(2)“三酸”与“两碱”之间均可反应,若用化学方程式表示有六个(酸过量时),若用离子方程式表示却只有两个,请写出这两个离子方程式(酸过量时)。
___________________________________ ;_____________________________________。
三、(共2小题,16分)
28、下图所涉及的物质均为中学化学中的常见物质,其中
(1)C、D、E、F都为单质,其余为化合物
(2)C、D、E 在常温下为气体,其它物质为固体或液体
(3)A、I 两种化合物的焰色反应分别为紫色和黄色
(4)反应 ① ② 的一些生成物已经略去,有些反应的条件未列出
它们存在如下转化关系。
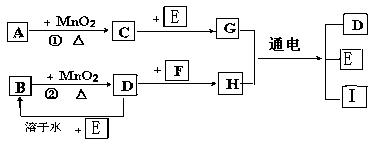 |
(1)写出有关物质的名称或化学式:
A ,D ,F ,I 。
(2)指出MnO2在相关反应中的作用:反应 ① 中是 剂,反应 ② 中是 剂。
(3)写出B与MnO2共热获得D的化学方程式 ______ 。
(4)写出G 、H混合液通电后发生反应的化学方程式______________________________。
29、镁和氢氧化钾都是重要的工业产品。请回答:
(1)工业上电解氯化镁制取镁的化学方程式是 。
(2)氯化镁溶液与氢氧化钾溶液反应的离子方程式是 。
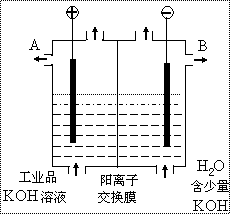 (3)工业品氢氧化钾的溶液中含有某些含氧酸根杂
(3)工业品氢氧化钾的溶液中含有某些含氧酸根杂
质,可用离子交换膜法电解提纯(类似于氯化
钠溶液的电解)。电解槽内装有阳离子交换膜
(只允许阳离子通过),其工作原理如图所示。
① 通电开始后,与电源_______极
(填正、负)相连的一极附近溶
液的pH会增大
② 除去杂质后的氢氧化钾溶液从
液体出口 (填写“A”或“B”)
四、实验题:(共2小题19分)
30、选择下列实验方法分离物质,将分离方法的序号填在横线上。
A.萃取分液B.升华C.结晶D.分液 E.蒸馏 F.层 析 G.过滤
(1)______分离饱和食盐水与沙子的混合物。
(2)______从硝酸钾和氯化钠的混合液中获得硝酸钾。
(3)______分离水和汽油的混合物。
(4)______分离CCl4(沸点为76.75℃)和甲苯(沸点为110.6℃)的混合物。
31、完成下题中的空格部分
实验室制配1.00 mol/L的NaOH溶液500 mL,有以下仪器:① 烧杯 ②100 mL量筒
③1000 mL容量瓶 ④500 mL容量瓶 ⑤玻璃棒 ⑥托盘天平(带砝码) ⑦分液漏斗
(1)配制时,必须使用的仪器有____________(填代号),
还缺少的仪器是(填名称)___ 。
(2)实验两次用到玻璃棒,其作用分别是:______________、______________。
(3)配制时,一般可分为以下几个步骤:
① 计算 需NaOH质量_____g。
② 称量 用天平准确称取所需氢氧化钠固体。
③ 溶解 向氢氧化钠固体中加入少量___________,用玻璃棒慢慢搅动,使其完全溶解,
__________________________。
④ 转移 将烧杯中的溶液用玻璃棒小心的引流到 _____________________中,用蒸馏水洗涤烧杯内壁2~3次,并将每次洗涤液都注入容量瓶中,轻轻振荡容量瓶,使溶液混合均匀。
⑤ 定容 继续缓缓往容量瓶内加水,直到液面接近刻度1—2 cm处,改用________加水,使溶液凹面恰好与________________。再将容量瓶塞盖好,反复上下颠倒,摇匀。
(4)试分析下列变化并用“偏大”“偏小”或“不变”填写:
① 小烧杯、玻璃棒没洗涤,溶液中溶质的浓度 。
② 所用容量瓶中,已有少量蒸馏水,则溶液中溶质的浓度 。
③ 转移时不慎将溶液倒在瓶外,溶液中溶质的浓度 。
④ 定容时视线未平视液面,若俯视会使体积偏小,则溶液中溶质的浓度 。
(5)若配制时,因滴加蒸馏水不慎略超过了容量瓶刻度线,此时实验应如何继续进行?
答: 。
五、计算题:(共1小题,7分)
32、一个体重50 kg的健康人约含铁2 g。正常人体每日需铁量为11.5 mg。某种补铁药品标签上注明:每 100 mL 含 FeSO4 450 ~460 mg 。实验室为测定这种补铁药品的含铁量,做了以下实验:
取 20.00 mL 该药品,用0.010 00 mol/L KMnO4 溶液滴定,当加入到 12.00 mL 时,紫色不再褪去,反应的离子方程式为: MnO4- + 5 Fe2+ + 8 H+ = Mn2+ + 5 Fe3+ + 4 H2O
问:(1)20.00 mL 溶液中含Fe2+ 的物质的量是多少?
(2)通过计算说明,测得的结果是否符合药品标签上的注明范围?
(没有计算过程,此题得 0 分)
六、附加题:(共6分)
(本题供学有余力的同学做,记入总分,但不超过100分)
33、合成氨工业生产中所用的α-Fe催化剂的主要成分是FeO、Fe2O3。
(1)某FeO、Fe2O3混合物中,铁、氧的物质的量之比为4∶5,其中Fe2+ 与Fe3+ 物质的量之比为 。
(2)当催化剂中Fe2+ 与Fe3+ 的物质的量之比为1∶2时,其催化活性最高,此时铁的氧化物混合物中铁的质量分数为 (可用分数表示;若用小数表示,请保留2位小数)。
(3)以Fe2O3为原料制备上述催化剂,可向其中加入适量炭粉,发生如下反应:
2 Fe2O3+C == 4FeO+CO2↑。为制得这种活性最高的催化剂,应向480gFe2O3 粉末中加入炭粉的质量为 g
参考答案:
26、 KMnO4 、 Cl 2
27(1)纯碱。(2)H+ + OH- = H2O ;2 H++ CO32- = CO2 ↑+ H2O
28、(1)氯酸钾 氯气 钠氢氧化钠
(2)催化、氧化。
(3)MnO2+4HCl(浓)![]() MnCl2+Cl2↑+H2O
MnCl2+Cl2↑+H2O
(4)2NaCl+H2O![]() 2NaOH+Cl2↑+ H2↑
2NaOH+Cl2↑+ H2↑
29、(1)MgCl2== Mg +Cl2↑
(2)Mg2++2OH- = Mg(OH)2
(3)负、B
30、G、C、D 、E
31、(1)①④⑤⑥、胶头滴管
(2)搅拌、引流。
(3)① 20.0 ③ 蒸馏水、冷却至室温。④ 5 00 mL容量瓶 ⑤ 胶头滴管、刻度线相切。
(4)偏小、不变、偏小、偏大
(5)重新配制。
32、6.000*10-4 mol 、456 mg符合
33、1:1 、0.72 、6 g