高一化学第一学期期中试卷
相对原子质量: H-1、C-12、N-14、O-16、Na-23、Br-80、Al-27、S-32、Cl-35.5、Ba-137
一、 选择题(本题包括20小题共40分。每小题只有一个选项符合题意)
1、特殊方法把固体物质加工到纳米级(1-100nm,1nm=10-9m)的超细粉末粒子,然后制得纳米材料。下列分散系中的分散质的微粒直径和这种粒子具有相同数量级的是 ( )
A、溶液 B、悬浊液 C、胶体 D、乳浊液
2、下列各组物质,前者属于电解质,后者属于非电解质的是 ( )
A、NaCl晶体 BaSO4 B、 铜 二氧化硫
C、液态的醋酸 酒精 D、熔融的KNO3 硫酸溶液
3、下列反应不属于四种基本反应类型,,但属于氧化还原反应的是 ( )
A、 2F2+2H2O=4HF+O2 B、AgNO3+NaCl=AgCl↓ +NaNO3
C、3CO+Fe2O3![]() 2Fe+3CO2 D、MgCl2 (熔融)
2Fe+3CO2 D、MgCl2 (熔融) ![]() Mg+Cl2
↑
Mg+Cl2
↑
4、如果你家里的食用花生油混有水份,你将采用下列何种方法分离 ( )
A、过滤 B、蒸馏 C、分液 D、萃取
5、下列实验中用错试剂的是 ( )
A、用稀盐酸清洗做焰色反应的铂丝 B、用酒精萃取碘水中的碘
C、用稀盐酸洗去残留在试管壁上的氧化铜 D、用浓硫酸吸收二氧化碳混有的少量水蒸气
6、海带中含碘元素,有人设计如下步骤来提取碘:①通足量氯气 ②将海带烧成灰,向灰中加水搅拌 ③加入CCl4振荡 ④过滤 ⑤用分液漏斗分液。合理的操作顺序为 ( )
A、②一④一①一③一⑤ B、②一①一③一④一⑤
C、①一③一⑤一②一④ D、③一①一②一⑤一④
7、下列说法正确的是 ( )
A、32gO2占有的体积约为22.4L B、 22.4LN2含有阿伏加德罗常数NA个N2
C、标准状况下22.4LH2O的质量约为18g D、22gCO2与标准状况下11.2LHCl含有相同的分子数
8、有一真空储气瓶,净重400g,在相同条件下,装满氧气后重404克,装满另一种气体x时重405.5克,则x的相对分子质量为 ( )
A、44 B、64 C、71 D、48
9、下列电离方程式错误的是 ( )
A、CaCl2 = Ca2+ + 2Cl- B、NaHSO4 = Na++H++SO42-
C、HNO3 = H+ + NO3- D、KClO3 = K+ + Cl-+ 3O2-
10、等质量的下列物质中,所含分子数最少的是 ( )
A、Cl2 B、 HCl C、Br2 D、 HBr
11、已知氨水密度为0.990 g/mL时,NH3的质量分数为2%,氨水的密度为0.930 g/mL时,NH3的质量分数为18%,溶质质量分数分别为a%和5a%的氨水按等体积混合,混合溶液中NH3的质量分数为( )
A、3 a% B、6 a% C、> 3 a% D、< 3 a%
12、欲除去KNO3溶液中混有的少量Cu2+、Mg2+、SO42—,下列加入试剂的顺序中正确的是 ( )
A、 Ba(NO3)2、KOH、K2CO3、HNO3 B、K2CO3、Ba(NO3)2、KOH、HNO3
C、 KOH、K2CO3、Ba(NO3)2、HNO3 D、 Ba(NO3)2、K2CO3、HNO3、KOH
13、下列各组仪器:①漏斗;②容量瓶;③滴定管;④分液漏斗;⑤天平;⑥量筒;⑦胶头滴管;⑧蒸馏烧瓶。常用于物质分离的是 ( )
A、①③⑦ B、②⑥⑦ C、①④⑧ D、④⑥⑧
14、张青莲是我国著名的化学家,1991年他准确测得In的相对原子质量为114.818,被国际相对原子质量委员会采用为新的标准值。这是相对原子质量表中首次采用我国测定的相对原子质量值。则下列关于的说法中,错误的是 ( )
A、![]() In原子核外有49个电子
B、
In原子核外有49个电子
B、![]() In原子核内有49个中子
In原子核内有49个中子
C 、![]() In原子核内质子数和中子数之和等于其质量数为115 D 、
In原子核内质子数和中子数之和等于其质量数为115 D 、![]() In是In元素的一种核素
In是In元素的一种核素
15、某元素一种同位素原子的质子数为m,中子数为n,则下述论断正确的是 ( )
A、不能由此确定该元素的相对原子质量 B、这种元素的相对原子质量为m+n
C、若碳原子质量为W克;此原子的质量为(m+n)W克 D、核内中子的总质量小于质子的总质量
16、已知碳有三种常见的同位素:12C、13C、14C,氧也有三种同位素:16O、17O、18O,由这六种微粒构成的二氧化碳分子中,其相对分子质量最多有 ( )
A、 18种 B、 6种 C、7种 D、12种
17、在离子 RO3n- 中, 共有 x 个核外电子, R 原子的质量数为 A, 则 R 原子核内含有的中子数目是( )
A、 A–x+n+48 B、A–x+n+24 C、 A–x-n–24 D、 A+x-n–24
18、硼有两种天然同位素510B和511B,已知硼元素的相对原子质量为10.80。下列对510B的质量分数的判断中正确的是 ( )
A、 等于20% B、 略小于20% C、 略大于20% D、 等于80%
19、V mL Al2(SO4)3 溶液中有m g Al3+,则溶液中C (SO42-)为 ( )
 A、500m/9V mol/L B、125m/9V mol/L
A、500m/9V mol/L B、125m/9V mol/L
C、125m/36V mol/L D、125m/54V mol/L
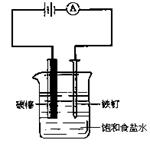
20、如图所示装配仪器,接通直流电源,电解饱和食盐水,则电解一段时间后,
在碳棒和铁钉表面都有气体生成,其中碳棒表面生成的气体是 ( )
A、Cl2 B、O2 C、H2 D、HCl
二、填空题(每空2分,共46分)
21.根据下列几种粒子的结构示意图,回答问题:(填编号)
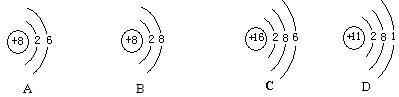
(1)其中属于阴离子的是 ,
 (2)属于金属元素的是
,
(2)属于金属元素的是
,
(3)具有相似化学性质的是 。
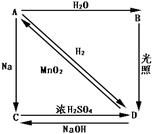
22、常温下,A是双原子分子气态单质,其密度为3.17g/L(标准状况下),B、C、D都是含A元素的化合物,转化关系如右图所示
⑴分别写出A、B、C、D的化学式:
A B C D
⑵写出A→B ,D→A的化学方程式
A→B D→A
23、10gNaOH需溶解在 g水中,才能使溶液中水分子与Na+离子的个数比为10∶1。
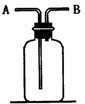 24、在标准状况下,将224L的HCl气体溶于635mL的水中(设水的密度为
1.00g/cm3 ,这种盐酸密度为1.19g/cm3),求所得盐酸的物质的量浓度为
。
24、在标准状况下,将224L的HCl气体溶于635mL的水中(设水的密度为
1.00g/cm3 ,这种盐酸密度为1.19g/cm3),求所得盐酸的物质的量浓度为
。
25、.右图所示装置有多种用途,请回答下列问题:
(1)洗气:除去CO中的水蒸气,装置内应盛放 ;
(2)检验:证明CO中混有CO2,装置内应盛放 ;
(3)集气:若用排空气法收集比空气轻的气体时,气体应从装置的 端通入;
若收集比空气重的气体,则气体从 端通入。(都填“A” 或“B”,下同)
(4)贮气:若要用水将装置中的氧气排出进行实验时,水应从 端通人。
(5)量气:若要测定实验室制得的少量O2的体积,则应在瓶内先装满水,再将O2从 端通入。
26、下图是一个实验室制取氯气并以氯气为原料进行特定反应的装置:
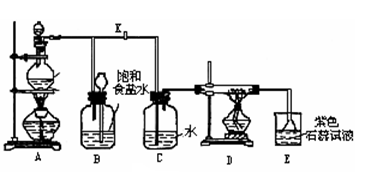
⑴实验开始时,先点燃A处的酒精灯,打开旋塞K,让Cl2充满整个装置,再点燃D处酒精灯,连接上E装置。Cl2通过C瓶后再进入D。D装置的硬质玻管内盛有炭粉,发生化学反应,其产物为CO2和HCl。试写出D中化学方程式: 。
⑵在E处,紫色石蕊试液的颜色由紫色变为红色,再变为无色,为什么?
。
⑶D处反应完毕后,关闭旋塞K,移去酒精灯,但由于余热的作用,A处仍有Cl2产生,此时B中的现象是 ,B的作用是 。
27、(1)用已称取的10.6 g Na2CO3 配制1000mL 0.1 mol/L标准溶液的正确顺序是 。
A、用适量蒸馏水洗涤烧杯和玻璃棒2次,洗涤液转移至容量瓶中
B、把样品加入烧杯并加适量水溶解,冷却至室温后转移至容量瓶中
C、选择1000mL容量瓶,并检验是否漏水
D、用胶头滴管向容量瓶中加水至刻度线
E、向容量瓶中加水至距刻度线1 ~ 2cm处
F、把容量瓶塞好,反复摇匀
(2)、实验室欲配制100mL0.5mol/L的NaOH溶液,配制过程中的下列做法会使所配浓度偏高的是 。
A、称量NaOH固体时,放在烧杯中且称量较慢
B、称量NaOH固体时,砝码与药品位置颠倒(没用游码)
C、溶解搅拌时,溶液溅到烧杯外面
D、移液前,容量瓶中有少量蒸馏水
E、移液时,忘记洗涤烧杯内壁
F、移液时,有少量溶液流到容量瓶壁外
G、定容时,加水超过刻度线,再用胶头滴及将过线的液体吸出
H、定容时,俯视刻度线
三、计算题(两小题,共14分)
28、(7分) 取50.0 mL NaCO3和Na2SO4的混合溶液,加入过量BaCl2溶液后得到14.51g白色沉淀,用过量稀硝酸处理后沉淀量减少到4.66g,并有气体放出,试计算:
(1)原混合液中Na2CO3和Na2SO4的物质的量浓度。
(2)产生的气体在标准状况下的体积。
29、(7分) 将某温度下的KNO3溶液200g蒸发掉10g水,恢复到原温度,或向其中加入10gKNO3固体,均可使溶液达到饱和。试计算:(1)该温度下KNO3的溶解度。(2)原未饱和溶液中溶质的质量分数。

 答题卷
答题卷
一 、选择题(本题共20小题,每小题2分,共40分;)
| 题号 | 1 | 2 | 3 | 4 | 5 | 6 | 7 | 8 | 9 | 10 |
| 答案 | ||||||||||
| 题号 | 11 | 12 | 13 | 14 | 15 | 16 | 17 | 18 | 19 | 20 |
| 答案 |
二、填空题(每空2分,共46分)
21、(6分) (1) (2) (3)
22、(12分) (1)
⑵
______________________________________________________________
23、(2分)
24、(2分)
25、(12分)(1) ; (2) ;
(3) ; 。(填“A”或“B”,下同)
(4) 。(5) 。
26、(8分)⑴ ,
⑵ 。
⑶ , 。
27、(4分)⑴ ⑵ 。
三、计算题(两小题共14分)
28、(7分).
29、(7分)

 答案
答案
一 、选择题(本题共20小题,每小题2分,共40分;)
| 题号 | 1 | 2 | 3 | 4 | 5 | 6 | 7 | 8 | 9 | 10 |
| 答案 | C | C | C | C | A | A | D | A | D | C |
| 题号 | 11 | 12 | 13 | 14 | 15 | 16 | 17 | 18 | 19 | 20 |
| 答案 | D | A | C | B | A | C | B | B | A | A |
二、填空题(每空2分,共46分)
21、(6分) (1) B (2) D (3) AC
22、(12分) (1) Cl2 HClO NaCl HCl
⑵ Cl2+H2O=HCl+ HClO
___MnO2+4HCl=MnCl2+Cl2↑+2H2O____________________________
23、(2分) 45
24、(2分) 11.9mol/L
25、(12分)(1) 浓硫酸 ; (2) 澄清石灰水 ;
(3) B ; A 。(填“A”或“B”,下同)
(4) A 。(5) B 。
26、(8分)⑴ C+2H2O+2Cl2△CO2+4HCl ,
⑵生成的HCl和残余Cl2溶与水,溶液显酸性,使石蕊试液变红,氯气与水反应同时生成了HClO,有漂白性,又使溶液褪色。
⑶气体体积增大,有明显的黄绿色,饱和食盐水流回长颈漏斗,
暂时储存残余氯气,防止空气污染 。
27、(4分)⑴ CBAEDF ⑵ H 。
三、计算题(两小题共14分)
28、(7分).
Na2CO3和Na2SO4的物质的量浓度分别为0.4 mol/L 1 mol/L
CO2气体体积1.12L
29、(7分)
该温度下KNO3的溶解度100g,
原未饱和溶液中溶质的质量分数47.5%