高一年级化学上学期期中统练
(时间:90分钟 满分:100分)
可能用到的相对原子质量:H:1 C:12 N:14 O:16 Na:23 Al:27 S:32 Ba:137
一、选择题:(本大题共28个小题,每小题2分,共56分。在每小题给出的四个选项中,只有一项是符合题目要求的。)
1.在实验室中,通常将金属钠保存在( )
A.水中 B. 煤油中 C. 四氯化碳中 D.汽油中
2.胶体区别于其它分散系的特征是( )
A.胶体粒子直径在1-100nm之间 B. 胶体粒子带电荷
C.胶体粒子不能穿过半透膜 D. 胶体粒子能够发生布朗运动
3.NaHSO4在水溶液中能够电离出H+、Na+、和SO42-。下列对于NaHSO4的分类中不正确的是( )
A.NaHSO4是盐 B.NaHSO4是酸式盐
C.NaHSO4是钠盐 D.NaHSO4是酸
4.氧化还原反应的实质是( )
A.氧元素的得与失 B.化合价的升降
C.电子的得失或电子对偏移 D.分子中原子重新组合
5.下列化学变化中,需加入氧化剂才能实现的是( )
A.C→CO2 B.CO2→ CO C.CuO→Cu D.H2SO4→BaSO4
6.下列物质中既能跟稀H2SO4反应, 又能跟氢氧化钠溶液反应的是( )
.... ①NaHCO3 ②Al2O3 ③Al(OH)3 ④Al
A.③④ B.②③④ C.①③④ D.全部
7.下列溶液中的Cl-浓度与50 mL 1 mol ·L-1 MgCl2溶液中的Cl-浓度相等的是( )
A.150 mL 1 mol·L-1 NaCl溶液
B.150 mL 2 mol·L-1 KCl溶液
C.75 mL 2 mol·L-1 CaCl2溶液
D.75 mL 1 mol ·L-1 AlCl3溶液
8.下列物质的水溶液能导电,但属于非电解质的是( )
A.Na2S B.Cl2 C. NaHCO3 D. CO2
9.甲、乙、丙、丁分别是氢氧化钙溶液、硝酸钾溶液、碳酸钠溶液、盐酸中的一种。已知甲和丙可以反应,甲和丁也可以反应,则下列说法正确的是( )
A.甲一定是氢氧化钙溶液 B.乙一定是硝酸钾溶液
C.丙不可能是碳酸钠溶液 D.丁只能是盐酸
10.下列离子方程式书写正确的是( )
A.铝粉投入到NaOH溶液中:2Al+2OH-══ 2AlO2-+H2↑
B.AlCl3溶液中加入足量的氨水:Al3++ 3OH- ══ Al(OH)3↓
C.FeCl2溶液跟Cl2反应:2Fe2++Cl2=2Fe3++2Cl-
D.三氯化铁溶液中加入铁粉:![]()
11.设NA表示阿伏加德罗常数,下列叙述正确的是 ( )
A.78g Na2O2与足量水充分反应时电子转移数为2NA
B.25℃、101.3kPa时,11.2L H2中含有的原子数为NA
C.4℃、101.3kPa时,54mL H2O中含有的分子数为3NA
D.2L 1mol·L-1 Na2SO4溶液中离子总数为3NA
12.下列化学方程式中,不能用H++OH-=H2O表示的是( )
A.2NaOH+H2SO4=Na2SO4+2H2O
B.Ba(OH)2+2HCl=BaCl2+2H2O
C.Cu(OH)2+2HNO3=Cu(NO3)2+2H2O
D.KOH+HCl=KCl+H2O
13.下列各组中的离子,能在溶液中大量共存的是( )
A.H+ Na+ CO32- Cl- B.Ba2+ Na+ Cl- SO42-
C.K+ H+ SO42- OH- D.Ag+ Al3+ H+ NO3-
14.下列各组中的两种物质作用时,反应条件(温度、反应物用量等)改变,不会引起产物改变的是( )
A.Na和O2 B.NaOH和CO2
C.Na2O2和CO2 D.Na2CO3和HCl
15.吸入人体內的氧有2%转化为氧化性极强的“活性氧”,它能加速人体衰老,被称为“生命杀手”,服用含硒元素(Se)的化合物亚硒酸钠(Na2SeO3),能消除人体內的活性氧,由此推断Na2SeO3的作用是( )
A.作还原剂 B.作氧化剂
C.既作氧化剂又作还原剂 D.既不作氧化剂又不作还原剂
16.在FeCl3和CuCl2混合液中,加入过量的铁粉,充分反应后,溶液中的金属离子是( )
A.Fe2+ B.Fe3+ 和Fe2+ C.Cu2+ 和Fe2+ D.Cu2+
17.下列有关Na2CO3和NaHCO3性质的比较中,正确的是( )
A.热稳定性:Na2CO3<NaHCO3
B.与稀盐酸反应的快慢:Na2CO3>NaHCO3
C.106g Na2CO3和84g NaHCO3分别与过量的盐酸反应,放出CO2的质量:Na2CO3>NaHCO3
D.常温时水溶性:Na2CO3>NaHCO3
18.有甲、乙、丙三瓶等体积等物质的量浓度的NaOH溶液,若将甲蒸发掉一半水分,在乙中通入少量的CO2,丙不变,然后分别向甲、乙、丙三瓶中加入同浓度的盐酸,完全反应后所需盐酸溶液的体积是( )
A.甲=丙>乙 B.丙>乙>甲 C.乙>甲=丙 D.甲=乙=丙
19.在![]() L Al2(SO4)3溶液中加入过量氨水,过滤得沉淀,然后在高温中灼烧沉淀最后得白色固体
L Al2(SO4)3溶液中加入过量氨水,过滤得沉淀,然后在高温中灼烧沉淀最后得白色固体![]() g,则溶液中SO
g,则溶液中SO![]() 的物质的量浓度是( )
的物质的量浓度是( )
A.![]() mol·L-1 B.
mol·L-1 B.![]() mol·L-1
mol·L-1
C.![]() mol·L-1 D.
mol·L-1 D.![]() mol·L-1
mol·L-1
20.证明溶液中是否有Fe2+,其操作正确的顺序是( )
①加少许酸化的KMnO4溶液 ②加少许氯水 ③滴加少许KSCN溶液
A.①② B.②③ C.①②③ D.③②
21.某溶液中只含有Na+、Al3+、Cl-、SO42- 四种离子,已知前三种离子的个数比为3∶2∶1,则溶液中Al3+和 SO42-的离子个数比为( )
A.1∶2 B.1∶4 C.3∶4 D.3∶2
22.一定条件下硝酸铵受热分解的化学方程式为:
5NH4NO3![]() 2HNO3+4N2+9H2O,在反应中被氧化与被还原的氮原子数之比为( )
2HNO3+4N2+9H2O,在反应中被氧化与被还原的氮原子数之比为( )
A. 5∶4 B.5∶3 C.1∶1 D.3∶5
23.氢化钙中的氢元素为—1价,它可用做生氢剂,反应的化学方程式是:CaH2 + 2H2O == Ca(OH)2 +2H2↑。该反应中,水的作用是
A.溶剂 B.还原剂
C.氧化剂 D.既是还原剂又是氧化剂
24.下列各组微粒中,在一定条件下均可以做氧化剂的是
A.Fe、SO2、CO2 B.S、HCl、SO2
C.Cl2、HClO、Mg D.ClO-、Cl、Ag+
25.下列变化不能经过一步实验直接完成的是
A.Al(OH)3→Al2O3 B..Al2O3→Al(OH)3
C.Al→AlO2- D. Al3+→Al(OH)3
26.下列各组物质相互之间发生反应后,再向得到的溶液中滴入KSCN溶液,溶液变成红色的是
A.氯水和FeCl2溶液 B.铁屑和CuCl2溶液
C.铁屑和过量的稀硫酸 D.过量的铁屑和FeCl3溶液
27.根据反应(1)~(4),可以判断下列4个物质的氧化性由强到弱的正确顺序是
(1)Cl2+2KI=2KCl+I2 (2)2FeCl2+Cl2=2FeCl3
(3)2FeCl3+2HI=2FeCl2+2HCl+I2 (4)H2S+I2=S+2HI
A.H2S>I2>Fe3+>Cl2 B.Cl2>Fe3+>I2>H2S
 C.Fe3+>Cl2>H2S>I2. D.Cl2>I2>Fe3+>H2S
C.Fe3+>Cl2>H2S>I2. D.Cl2>I2>Fe3+>H2S
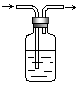
28.化学实验中的很多气体是用盐酸来制取的,这就导致了这些制取的气体中往往含有HCl杂质,要除去HCl杂质而得到纯净的目标气体,可用右图所示装置。如果广口瓶中盛装的是饱和NaHCO3溶液,则装置可以用于下列哪种气体除杂质
A.H2 B. O2 C. N2 D.CO2
以下试题答案请写在答题纸上。
二、填空题:(本题包括2小题,共12分)
29.(6分)(1)鉴别KCl溶液和K2CO3溶液的试剂是 ,
有关离子方程式为 。
(2)除去混入NaCl溶液中少量NaHCO3杂质的试剂是 ,
有关离子方程式为 。
(3)除去Na2CO3粉末中混入的NaHCO3杂质用 方法,
有关化学方程式为 。
30.(6分)火药是中国的“四大发明”之一,永远值得炎黄子孙骄傲,也永远会激励着我们去奋发图强。黑火药在发生爆炸时,发生如下的反应:2KNO3+3C+S===K2S+N2↑+3CO2↑。其中被还原的元素是 ,被氧化的元素是 ,氧化剂是 ,还原剂是 ,氧化产物是 ,还原产物是 。
三、推断题:(本题包括1小题,共10分)
31.已知有以下物质相互转化,其中A为单质。
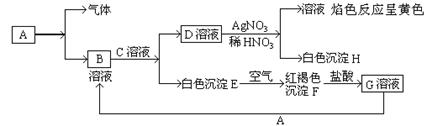
试回答:(1)写出B的化学式 D的化学式 。
(2)写出由A生成B的离子方程式 。
(3)写出由E转变成F的化学方程式 。
(4)向G溶液加入A的有关离子反应方程式 。
四、实验题:(本题包括2小题,共14分)
32.(4分)用Na2CO3固体配制1mol·L-1 的Na2CO3溶液100mL。
(1)供选用的仪器有:①玻璃棒;②胶头滴管;③100mL量筒;④100mL容量瓶;⑤250mL量筒;⑥天平;⑦50mL烧杯;应选用的仪器(填编号) 。
(2)应称取Na2CO3的质量为 。
33.(10分) 在常温下,Fe与水并不起反应,但在高温下,Fe与水蒸气可发生反应。 应用下列装置,在硬质玻璃管中放入还原铁粉和石棉绒的混合物,加热,并通入水蒸气,就可以完成高温下“Fe与水蒸气的反应实验”。
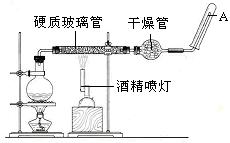
请回答该实验中的问题。
(1)写出该反应的反应方程式: ;该氧化还原反应的氧化剂是 ,转移电子数为 。
(2)实验前必须对整套装置进行 。
(3)圆底烧瓶中盛装的水,该装置受热后的主要作用是 ;烧瓶底部放置了几片碎瓷片,碎瓷片的作用是 。
(4)干燥管中盛装是的物质是 ,作用是 。
(5)试管中收集气体是 ,如果要在A处玻璃管处点燃该气体,则必须对该气体进行 。
五、计算题:(本题包括2小题,共8分)
34.(4分)某种待测浓度的H2SO4溶液20mL,加入10mL0.5mol·L-1 BaCl2溶液,恰好完全反应。问(1)得到BaSO4沉淀多少克?(2)待测H2SO4溶液的物质的量浓度是多少?
35.(4分)加热10.0克碳酸钠和碳酸氢钠的混合物至质量不再变化,剩余固体的质量为8.45克,求混合物中碳酸钠的质量分数。
 答题纸
答题纸
可能用到的相对原子质量:H:1 C:12 N:14 O:16 Na:23 Al:27 S:32 Ba:137
二、填空题:(本题包括2小题,共12分)
29.(1)试剂是 ,
离子方程式为 。
(2)试剂是 ,
离子方程式为 。
(3)用 方法,
化学方程式为 。
30.被还原的元素是 ,被氧化的元素是 ,氧化剂是 ,还原剂是 ,氧化产物是 ,还原产物是 。
三、推断题:(本题包括1小题,共10分)
31.(1)写出B的化学式 D的化学式 。
(2) 。
(3) 。
(4) 。
四、实验题:(本题包括2小题,共14分)
32.(1)应选用的仪器(填编号) 。
(2)应称取Na2CO3的质量为 。
33.(1)方程式: ;氧化剂是 ,转移电子数为 。
(2) 。
(3) ; 。
(4) ,作用是 。
(5)气体是 ,对该气体进行 。
五、计算题:(本题包括2小题,共8分)
34.
35.
化学答案
一、选择题:(本大题共22个小题,每小题2分,共44分。在每小题给出的四个选项中,有且只有一项是符合题目要求的。)
| 1 | 2 | 3 | 4 | 5 | 6 | 7 | 8 |
| B | A | D | C | A | D | C | D |
| 9 | 10 | 11 | 12 | 13 | 14 | 15 | 16 |
| B | C | C | C | D | C | A | A |
| 17 | 18 | 19 | 20 | 21 | 22 | 23 | 24 |
| D | D | B | D | A | B | C | B |
| 25 | 26 | 27 | 28 | ||||
| B | A | B | D |
二、填空题:(本题包括2小题,共12分)
29.(6分)
(1)盐酸、CO32-+2H+=CO2↑+H2O;(2)盐酸、HCO3-+H+=CO2↑+H2O;(3)加热:2NaHCO3![]() Na2CO3+CO2↑+H2O (其它合理答案均可)
Na2CO3+CO2↑+H2O (其它合理答案均可)
30.(6分)氮和硫;碳;KNO3和硫;碳 ;CO2 ;K2S和N2 。
三、推断题:(本题包括1小题,共10分)
31.(1)FeCl2 NaCl (2)2Na+2H2O=2Na++2OH-+H2↑
(3) 4Fe(OH)2+O2+2H2O=4Fe(OH)3 (4)2Fe3++Fe=3Fe2+
四、实验题:(本题包括2小题,共14分)
32.(1)①②④⑥⑦(2分) (2)10.6 g (2分)
33.(每空1分)(1)![]() ;H2O;8e-
;H2O;8e-
(2)气密性检验。
(3)为硬质玻璃管内Fe与水蒸气的反应实验提供持续不断的水蒸气;防止暴沸事故的发生。
(4)碱石灰干燥剂;除去反应产生的H2中的水蒸气。
(5)H2;验纯。
五、计算题:(本题包括2小题,共8分)
34、(4分,每问2分)1.165g 0.25mol·L-1
35.(4分)58%