高一年级化学上学期期中考试
高一年化学试题
可能用到的相对原子质量:Cl-35.5 Na-23 H-1 S-32 O-16 K-39 N-14 Fe-56 Rb-85.5 Cs-133 Li-9 C-12 Cu-64
一、选择题(满分30分,每一小题2分,每一小题只有一个正确答案)
1.有关氧化还原反应的叙述正确的是
A.氧化还原反应的实质是有氧元素的得失
B.氧化还原反应的实质是元素化合价的升降
C.氧化还原反应的实质是电子的转移(得失或偏移)
D.物质所含元素化合价升高的反应是还原反应
2..吸收人体内的O2有2%转化为氧化性极强的活性氧副产物,如氧自由基等,这些活性氧能加速人体衰老,被称为“生命杀手”。中国科学院尝试用含硒(Se)的化合物Na2SeO3清除人体内的活性氧。在消除活性氧时,Na2SeO3作用是
A、既是氧化剂又是还原剂 B、还原剂
C、氧化剂 D、以上均不是
3. 下列变化需要加入氧化剂才能实现的是
A.Na2SO3→SO2 B.HCl→Cl2
C.H2SO4(浓) → SO2 D.SO2→S
4.已知在某温度时发生如下三个反应:
(1)C+CO2=2CO、(2)C+H2O=CO+H2、
(3)CO+H2O=CO2+H2 据此判断,该温度下C、CO、H2的还原性强弱顺序是
A.CO>C>H2 B.C>CO>H2
C.C>H2>CO D.CO>H2>C
5.下表中强电解质、弱电解质、非电解质的分类,正确的是
|
| A | B | C | D |
| 强电解质 | NaOH | CuSO4 | BaSO4 | CH3COOH |
| 弱电解质 | H2O | CaCO3 | CO2 | 铝 |
| 非电解质 | 酒精 | 水银 | O2 | CO2 |
6.下列叙述能说明某物质是弱电解质的是
A.难溶于水 B.熔化时不导电
C.不是离子化合物,而是共价化合物
D.溶液中存在已电离的离子与未电离的分子
7.下列关于试剂保存正确的是
A.氢氧化钠固体保存在橡胶塞的试剂瓶中
B.碱金属钠在水中储存
C.碱金属锂在煤油中储存
D.固体过氧化钠敞口放在广口瓶中
8.在显碱性的无色溶液中能大量共存的离子组是
A.Na+ Ca2+ HCO3- NO3- B. Na+ Ba2+ Cl- SO42-
C.K+ Na+ Cl- Cu2+ D. Na+ Ba2+ NO3- I-
9.下列属于化合反应的是
A.2 Na+2H2O==2NaOH+H2↑
B.Cl2+ H2O==HCl+HClO
C.HCl+NaOH==NaCl+H2O
D.Cl2+H2==2HCl
10.下列属于氧化还原反应的是
A.Cl2+ H2O==HCl+HClO
B. HCl+NaOH==NaCl+H2O
C. NaCl+AgNO3==AgCl↓+NaNO3
D.Cu(OH)2+2HCl==CuCl2+2H2O
11.下列反应的离子方程式正确的是
A.盐酸中加入铁粉Fe+2H+==Fe3++ H2↑
B.碳酸钙中加入盐酸 CaCO3+2H+==Ca2++CO2↑+H2O
C.硝酸银溶液中加入盐酸 AgNO3+ HCl== AgCl↓+HNO3
D.金属钠和水反应 Na+H2O==Na+ +OH- +H2
12.进行颜色反应后的铂丝需用下列物质洗涤
A. H2SO4 B.HCl C. HNO3 D. H2O
13. 在Fe2(SO4)3和 FeSO4的混合物中,已知S元素的质量分数为a%,则O元素的质量分数为
A.4a% B.1-5a% C.2a% D.0.5a%
14.下列粒子中,既具有氧化性又具有还原性的是
A. Fe2+ B. H+ C. Cl- D. Na+
15.下列四种基本反应类型中一定有单质生成的是
A.置换 B分解 C. 化合 D.复分解
二.选择题 (满分30分,每一小题3分,每一小题只有一个正确答案)
16.将7.8g 过氧化钠加入到92.2克水中,完全反应后,则溶液的质量分数为
A 大于8% B. 小于8% C. 等于8% D.无法判断
17.已知氢化钠(NaH)可与水反应生成氢氧化钠和氢气NaH+ H2O= NaOH+ H2,有关此反应说法不正确的是
A.氢化钠是还原剂 B.氢气是还原产物又是氧化产物
C.此反应是氧化还原反应 D.水是还原剂
18.下列物质能用来鉴别 Na2CO3 和 NaHCO3 溶液的是
A . CaCl2 B. Ca(OH)2 C.石蕊试液 D. CO2
B19. 铷和另一种碱金属的合金4.6g和足量的水完全反应时产生氢气0.2g,则合金中另一金属一定
A.锂 B.钠 C.钾 D.铯
20.在2H2S+SO2=3S+2H2O 反应中,氧化产物和还原产物的质量比为
A.2 :1 B.1 : 2 C. 1 : 1 D.3 : 2
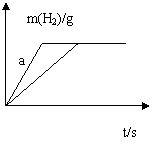
| |
A.
|
B. 投入的Na的质量一定小于K的质量
C. 曲线a的为Na,b为K
D. 稀盐酸的量一定是不足量的
22.下列离子在溶液中可能大量共存的是
A. Na+ H+ OH- Cl- B. Na+ OH- H CO3- Cl-
C. Na+ H+ Ag+ Cl- D.K+ Mg2+ NO3- Cl-
23. 将7.2g的CO与H2组成的混合气体与足量的O2充分燃烧后,立即通入足量的Na2O2固体中,固体的质量增加
A.2.1g B.3.6g C.7.2g D.不可求
24. 已知钡的活动性处于钾和钠之间,则下述说法中可能实现的是
A.钡可从氯化钾溶液中置换出钾 B.钡可从冷水中置换氢
C.钡可从氯化钠溶液中置换出钠 D.在溶液中钡离子可氧化金属锌,使之成为锌离子
25.碳酸钠和碳酸氢钠的混合物加热到质量不再变化时,质量减少了7.44g,以下结论错误的是
A产生CO2 5.28g B原混合物中含NaHCO3 20.16g
C原混合物中一定含Na2CO3 12.72g
D无法根据上述数据求出原混合物中Na2CO3的质量
三、填空题
26.碱金属元素中和水反应最剧烈的是 (填元素符号),等质量和水反应产生氢气最多的是 (填元素符号)
27.H2O的摩尔质量
28.已知:3Cu+8HNO3稀=3Cu(NO3)2+2NO+4H2O。在该反应中还原剂是 ,还原产物是 ,被还原元素是 ,当有64gCu全部参加反应时,转移电子的物质的量为 mol
将该反应改写成离子方程式: 。
29. 0.2molH2O分子中含 mol H,10gNaOH的物质的量为 mol
30.称取一定质量的纯碱,溶于水后与盐酸完全反应放出CO2,用“增大”或“减少”填空:
(1)若纯碱中含NaHCO3,则所需盐酸用量 ,产生的气体 。
(2)若纯碱中含K2CO3,则所需盐酸用量 ,产生的气体 。
31.将7.8g 过氧化钠放到足量的水中,充分反应后使得1个Na+周围有 9 个H2O 分子,需要水的体积为 ml
四,推断题
32.化合物中均含有某种金属元属,经焰色反应均为紫色,其中
(1)
X![]() Y+CO2+H2O (2) X+Z===Y+H2O
Y+CO2+H2O (2) X+Z===Y+H2O
(3) Z+CO2===Y+H2O (4)Z+CO2===X
写出化学式X Y Z
写出(1)的化学反应方程式
写出(2)的离子反应方程式
五.实验题
33.某溶液中可能有Na+ K+ CO32- SO42- 等离子中的全部或几种,先进行以下连续操作:(1)用洁净铂丝蘸取溶液在无色火焰上灼烧,火焰呈黄色 (2)溶液中加入过量的稀硫酸后无气体放出,在加入硝酸钡溶液后产生白色沉淀,
则溶液中一定存在的离子是
一定不存在的离子是
无法确定的离子是
34.现有一定量含有氧化钠杂质的过氧化钠试样,请从下图中选用适当的实验装置,涉及一个最简单的实验,测定过氧化钠的纯度.
可供选用的反应物有:碳酸钙 盐酸 水
(1) 请写出实验中氧化钠,过氧化钠分别发生反应的化学方程式
(2) 应选用的装置是
(3)所选用的装置的连接顺序是
高一年化学试题答题卡
| 题号 | 一 | 二 | 三 | 四 | 五 | 总分 |
| 得分 |
|
|
|
|
|
|
一.
| 题号 | 1 | 2 | 3 | 4 | 5 | 6 | 7 | 8 | 9 | 10 | 11 | 12 | 13 | 14 | 15 |
| 选项 |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
二.
| 题号 | 16 | 17 | 18 | 19 | 20 | 21 | 22 | 23 | 24 | 25 |
| 选项 |
|
|
|
|
|
|
|
|
|
|
三
26.(2分) 27 (2分 )
28.(6分)
29 (4分)
30. (4分)(1)
(2)
31. (2分)
四.32 (7分) X Y Z
五
33 (6分)
34 (7分)
(1)
(2)
(3)